
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最差的是Y | |
| B. | X元素形成的单核阴离子还原性强于Y | |
| C. | Z元素氧化物对应水化物的酸性强于Y | |
| D. | Y元素单质在化学反应中只表现出氧化性 |
分析 W、X、Y、Z四种短周期元素,W的气态氢化物可与Z的气态氢化物反应生成离子化合物,应是铵盐,由元素在周期表中的物质可知,W是N元素、X为氧元素、Y为硫元素、Z为氯元素,据此解答.
解答 解:W、X、Y、Z四种短周期元素,W的气态氢化物可与Z的气态氢化物反应生成离子化合物,应是铵盐,由元素在周期表中的物质可知,W是N元素、X为氧元素、Y为硫元素、Z为氯元素.
A.非金属O>S,Cl>S,则其氢化物中H2S最不稳定,故A正确;
B.非金属O>S,则阴离子还原性S2->O2-,故B错误;
C.只有氯元素的最高价含氧酸才一定比Y的含氧酸酸性强,故C错误;
D.S与氢氧化钠的反应中既表现氧化性,也表现了还原性,故D错误;
故选A.
点评 本题考查位置结构性质关系、元素周期律等,难度不大,推断元素是解题的关键,注意整体把握元素周期表的结构.


科目:高中化学 来源: 题型:选择题
| A. | 将水加热到100℃,pH=6:c(H+)>c(OH-) | |
| B. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| C. | 0.1mol•L-1 的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 同浓度的三种溶液:①CH3COONH4②NH4Cl③NH3•H2O中,c(NH4+)由大到小的顺序是②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
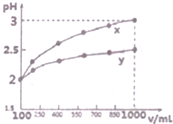 (1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
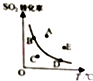 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
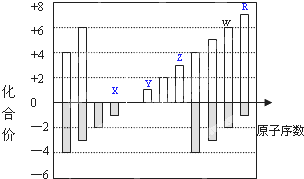 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WO3和水反应形成的化合物是离子化合物 | |
| D. | 原子半径:Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com