
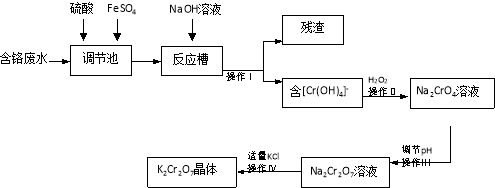
【题目】某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如下。
已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应: 。
(2)操作Ⅰ得到的残渣的化学式为 。
(3)操作Ⅲ调节pH时最适合作为调节剂的是
A.4mol·L-1盐酸 B.6mol·L-1硫酸
C.石灰乳 D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
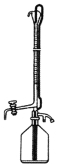
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点 。
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为 mg·L-1(用含a、b的式子表示)。
【答案】(1)Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(2)Fe(OH)3;(3)B;(4)①操作简单、无视力误差、计量精确;②520ab。
【解析】
试题分析:(1)利用Cr2O72-的氧化性,与Fe2+的还原性发生氧化还原反应,根据化合价升降法进行配平,离子反应方程式为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O;(2)加入氢氧化钠反应槽中发生Fe3++3OH-=Fe(OH)3↓,操作I是过滤,残渣为Fe(OH)3;(3)根据2CrO42-+2H+![]() Cr2O72-+H2O,以及实验目的,应加入酸,促使平衡向正反应方向进行,故C、D错误;因为Cr2O72-具有强氧化性,能把Cl-氧化成Cl2,故选项A错误,选项B正确;(4)①①操作简单、无视力误差、计量精确;②建立关系式:Cr2O72-~2Y4-,因此Cr的质量的为b×10-3×a×52×2×103/2mg=52abmg,浓度为52ab/100×10-3mg·L-1=520abmg·L-1。
Cr2O72-+H2O,以及实验目的,应加入酸,促使平衡向正反应方向进行,故C、D错误;因为Cr2O72-具有强氧化性,能把Cl-氧化成Cl2,故选项A错误,选项B正确;(4)①①操作简单、无视力误差、计量精确;②建立关系式:Cr2O72-~2Y4-,因此Cr的质量的为b×10-3×a×52×2×103/2mg=52abmg,浓度为52ab/100×10-3mg·L-1=520abmg·L-1。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】下列各化合物的命名正确的是( )
A.CH2═CH﹣CH═CH2 1,3﹣二丁烯
B.CH3COOCH2CH2OOCCH3乙二酸二乙酯
C.CH3CH2CH(OH)CH3 3﹣丁醇
D.![]() 2﹣甲基丁烷
2﹣甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的。

下列有关说法正确的是
A. 第①步中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
B. 从第③步到第⑤步的目的是浓缩、富集溴
C. 第①到第⑤步中,涉及到氧化还原反应共有2步
D. 第④步中,SO2起氧化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线


若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02mol·L-1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1;
2SO3(g) ΔH1;
反应2:2NO(g)+O2(g) ![]() 2NO2(g) ΔH2;
2NO2(g) ΔH2;
若ΔH1<ΔH2<0,则反应3:SO2(g)+NO2(g) ![]() SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见右图)。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。
SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R元素的单质4.5g,跟足量的硫酸反应生成R2(SO4)3,并放出5.6L的H2(标准状况下).试求:
(1)R的相对原子质量为
(2)若R原子中质子数比中子数少1,则R是(填元素符号) ,它在元素周期表的位置为第 周期第 族.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3.9gNa2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3氯戊烷是一种有机合成中间体,下列有关3氯戊烷的叙述正确的是 ( )
A.3氯戊烷的分子式为C6H9Cl3
B.3氯戊烷属于烷烃
C.3氯戊烷的一溴代物共有3种
D.3氯戊烷的同分异构体共有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)。

已知:①A是![]() 的混合液。
的混合液。
②IV中的电解方程式为:![]()
(l)A中属于还原产物的是________________________。
(2)加人MnCO3、Zn2(OH)2CO3的作用 ________________________。
II需要加热的原因是:____________________。C的化学式是 _______________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_________________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是_____________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、___________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com