
【题目】R元素的单质4.5g,跟足量的硫酸反应生成R2(SO4)3,并放出5.6L的H2(标准状况下).试求:
(1)R的相对原子质量为
(2)若R原子中质子数比中子数少1,则R是(填元素符号) ,它在元素周期表的位置为第 周期第 族.
【答案】(1)27;(2)Al;三;ⅢA.
【解析】试题分析:(1)根据单质和稀硫酸的反应中电子转移守恒,计算R的物质的量,再根据M=确定R元素原子的相对原子质量;
(2)相对原子质量在数值上近似等于质量数,据A=Z+N来确定质子数,确定元素原子的核外电子排布以确定该元素在周期表中的位置.
解:(1)设4.5gR元素单质的物质的量为n,根据电子转移守恒,则:
n×3=![]() ×2,解得n=mol,
×2,解得n=mol,
所以R的摩尔质量M==![]() =27g/mol,
=27g/mol,
所以R元素的相对原子质量为27,
故答案为:27;
(2)若R原子中质子数比中子数少1,Z+N=Z+Z+1=27,Z=13,R是Al,位于第三周期第ⅢA族,
故答案为:Al;三;ⅢA.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A.NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B.达到化学平衡时,4v正(O2)= 5v逆(NO )
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物相应说法正确的是( )
A.乙烷中混有乙烯,提纯方法:催化剂条件下与氢气混合反应
B.乙酸乙酯中混有乙酸,提纯方法:用过量饱和碳酸钠溶液洗涤后分液
C.乙醇中混有乙酸,验证乙酸存在的方法:加金属钠,看是否有气泡
D.蔗糖水解产物的验证:在冷却后的水解液中直接加入银氨溶液,水浴加热,看是否有银镜产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2H、13C、15N、18O、34S等常用作环境分析指示物,下列对它们的说法正确的是
A. 34S原子核内的中子数为16 B. 16O与18O互成为同位素
C. 13C和15N原子核内的质子数相差2 D. 2H的核外电子数比1H多一个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的原理如图所示:

回答下列问题:
(1)反应时电子从 极流出(填a 或b )
(2)若电解质溶液为H2SO4溶液,则正极的电极反应式为 ,电池工作一段时间后,电解质溶液的酸性将会 (填“增强”、“减弱”或“不变”)
(3)若电解质溶液为KOH溶液,则负极的电极反应式为 ,
(4)电池工作时若转移4mol电子,则理论上需通入标况下的氢气 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如下。
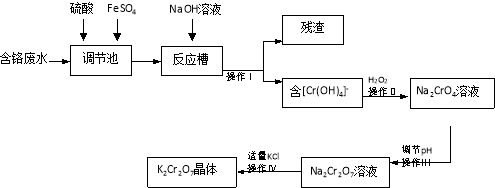
已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应: 。
(2)操作Ⅰ得到的残渣的化学式为 。
(3)操作Ⅲ调节pH时最适合作为调节剂的是
A.4mol·L-1盐酸 B.6mol·L-1硫酸
C.石灰乳 D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点 。
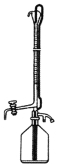
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为 mg·L-1(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH2 = CH—CH2OH的性质可能有:① 加成反应 ②氧化反应③ 酯化反应 ④ 中和反应
A.只有①③ B.只有①②③ C.只有①③④ D.只有①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做乙醛还原性的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一个试管里混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因是( )
A.氢氧化钠的量不够 B.硫酸铜的量不够
C.乙醛溶液太少 D.加热时间不够
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)常温下,可用铝和铁质容器盛装浓硫酸的原因是 。
(2)但是铝制容器不能装NaOH等碱溶液,原因是(用离子方程式表示) 。
(3)工业上冶炼铝,反应的化学方程式为 。
(4)某实验小组利用下图装置验证铁与水蒸气的反应。
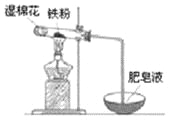
①湿棉花的作用是 ,试管中反应的化学方程式是 。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是 (填序号)。
a.一定有Fe2+、H+和Fe3+b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有H+d.一定有Fe3+、H+,可能有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com