

| A. | 18g 冰(图甲)中含 O-H 键数目为 4NA | |
| B. | 28g 晶体硅(图乙)中含有σ键数目为 2NA | |
| C. | 44g 干冰(图丙)中含有 NA个晶胞结构单元 | |
| D. | 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA |
分析 A.1个水分子中含有2个O-H键;
B.硅晶体中,每个硅原子与气体4个Si形成4个Si-Si键,根据均摊法计算出1mol硅形成的Si-Si数目;
C.二氧化碳晶体是立方面心结构,1个晶胞结构单元含有4个二氧化碳分子;
D.在石墨烯中,每个碳原子周围有两个C-C单键和一个C=C双键,所以每个碳原子实际占化学键为1.5个,12g石墨烯即1mol所含碳碳键数目为1.5NA,据此判断.
解答 解:A.1个水分子中含有2个O-H键,18g冰的物质的量为1mol,含O-H键数目为2NA,故A错误;
B.28g硅晶体中含有1molSi原子,晶体硅中,每个硅原子与其它4个Si形成4个Si-Si键,则每个硅原子形成的共价键为:$\frac{1}{2}$×4=2,则1mol单质硅含有2molSi-Si键,含有2NA个σ键,故B正确;
C.1个晶胞结构单元含有4个二氧化碳分子,44g干冰中含有晶胞结构单元个数小于NA个,故C错误;
D.在石墨烯中,每个碳原子周围有两个C-C单键和一个C=C双键,所以每个碳原子实际占化学键为1.5个,12g石墨烯即1mol所含碳碳键数目为1.5NA,则C-C键数目小于1.5NA,故D错误;
故选:B.
点评 本题考查了晶体的结构,熟悉晶体硅、水分子、二氧化碳晶体的结构是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸的电离方程式:H2SO3?2H++SO32- | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式: | |
| D. |  互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
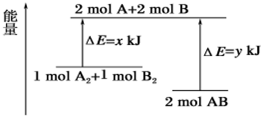
| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 因水分子间存在氢键,所以水加热到很高的温度都难以分解 | |
| B. | 1mol 冰中最多含有 4×6.02×1023个氢键,水分子间的氢键可表示为 O-H…O | |
| C. | 在“H2O(s)→H2O(l)→H2+O2”的变化过程中,被破坏的主要作用依次是氢键、极性键 | |
| D. | 等质量的水和冰,因水结冰后氢键数目变少,所以冰的密度比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用锌和稀硫酸反应制取氢气 | B. | 用氢气高温还原氧化铜得到单质铜 | ||
| C. | 用碳和高温水蒸气反应制取氢气 | D. | 用氯气和溴化钠溶液反应制取溴 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
有关电解质溶液下列说法正确的是
A.等体积、等浓度的Na2CO3、NaHCO3溶液混合后,3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
B.常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-)
C.若一元酸酸性HA>HB,则等体积、等浓度的NaA与NaB溶液中,前者的离子总数小于后者
D.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
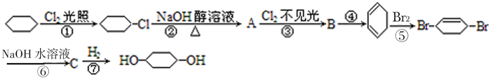
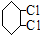 C:
C:
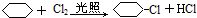 ;④:
;④: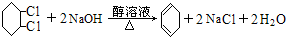 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com