
����Ŀ����Ȼ������Ԫ����Ҫ��������������Ҫ�ɷ�ΪAl2O3��FeO��Fe2O3��SiO2���У����ĵ��ʼ��仯������������������е�����Ӧ�ù㷺����ҵ�����������Ʊ�����ij�ֻ�����Ĺ����������£�
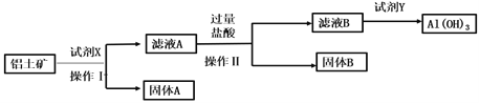
����˵����������( )
A.��ʵ����ʵʩ��������Ҫ�IJ���������©�����ձ���������
B.Ϊʹ��Ԫ��ȫ��ת��ΪAl(OH)3��ÿһ���������Լ��������
C.���Լ�X���������Լ��������ụ����Ҳ���Ƶ�Al(OH)3
D.����A����Ҫ�ɷ���FeO��Fe2O3
���𰸡�C
��������
��������Ҫ�ɷ�ΪAl2O3��FeO��Fe2O3��SiO2����������������������Һ��������������������Ӧ����ƫ�����ƺ����ƻ��Һ������AΪFeO��Fe2O3����ҺAΪƫ�����ơ������ơ��������ƵĻ��Һ������Һ�еμӹ��������ᣬ�����������������B������ҺBΪʣ������ᡢ�Ȼ������Ȼ��ƵĻ����Һ����������İ�ˮ�������������������������Ϸ������
A. �������̿�֪����Һ������ù��˵ķ������У����˲�����Ҫ�IJ���������©�����ձ�������������A��ȷ��
B. ������������������Һ��������֤������ȫ���ܽ⣻�������������������֤ƫ���������ȫ��ת��Ϊ�����ӣ���ˮ��������֤������ȫ������Al(OH)3����B��ȷ��
C. ��������Ҫ�ɷ�ΪAl2O3��FeO��Fe2O3��SiO2������������������Һ������AΪSiO2����ҺAΪ�Ȼ������Ȼ��������Ȼ���������Ļ��Һ���ټ����������������ƣ����������������������������������ҺΪƫ��������Һ��ƫ��������Һ�백ˮ����Ӧ�������Ƶ�Al(OH)3�������Լ�X���������Լ���������ܻ�������C����
D. ��������Ҫ�ɷ�ΪAl2O3��FeO��Fe2O3��SiO2����������������Һ��������������������Ӧ����ƫ�����ƺ����ƻ��Һ������AΪFeO��Fe2O3����ҺAΪƫ�����ơ������ơ��������ƵĻ��Һ����D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ����ı�����ȷ����( )
A. �ڻ�̬�����ԭ���У�p�����������һ������s�����������
B. ��̬Feԭ�ӵ���Χ�����Ų�ͼΪ![]()
C. ����Ԫ�ص縺�Աȵ�Ԫ�ش���ԭ�ӵ�һ�����ܱȵ�ԭ�ӵ�һ�����ܴ�
D. ����ԭ�Ӻ�������Ų����ص㣬Cu��Ԫ�����ڱ���λ��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ��������������Ķ���������Ԫ�ء�Y��Zͬ���������ڣ�X��Wͬ��������Y���ڲ�ͬ���ڣ�Y��Zԭ�ӵĵ���������X��Wԭ�ӵĵ�������֮��Ϊ5��4������˵����ȷ����( )
A.ԭ�Ӱ뾶��W��Z��Y��X
B.Y�ļ���̬�⻯������ȶ��Ա�Z��ǿ
C.��X��Z��ɵĻ���������Z��W��ɵĻ�����ֻ�ܷ������Ϸ�Ӧ
D.��X��Y��Z����Ԫ����ɵĻ�����������ᡢ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ҫ����100mL��10molL-1��NaCl��Һ���Իش����и��⣺
��1�������㣬Ӧ����������ƽ��ȡNaCl����___g��
��2��������Һʱһ��ɷ�Ϊ���¼������裺�ٳ����ڼ���۶��ݢ���Һ��ϴ�Ӣ��ܽ�����ȷ�IJ���˳��Ϊ�����ţ�___��
��3������ƿ�����������5���е�___
���¶� ��Ũ�� ������ ��ѹǿ �ݿ̶���
A.�٢ڢ� B.�ۢݢ� C.�٢ۢ� D.�ڢܢ�
��4������NaCl����������Һ�����������У�����Ҫ�õ�����___��������ţ�
A.������ B.100mL����ƿ C.�ձ� D.��ͷ�ι� E.ҩ�� F.������ƽ G.������
��5�����д�������ᵼ��������Һƫ�͵���___���������ţ���
A.����ʱ��������ƿ�̶�����
B.����ƿ��ԭ����������ˮ
C.���ݺ�����ƿ����ҡ�Ⱥ���Һ����ڿ̶��ߣ��㲹�伸��ˮ���̶ȴ�
D.���ƺ���Һ������ƿδ���ã��Ƴ�һЩ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ļ���ԭ�ϣ���������ˮâ��(Na2SO4)��̿�ۻ�ԭ���Ʊ���ԭ��Ϊ��Na2SO4��2CNa2S��2CO2��������Ҫ�������£�
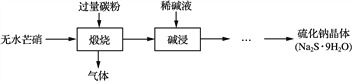
(1) ���������в���ϡ��Һ������ˮ���ã�������________________________________________________________________________��
(2) ��֪��I2��2S2O32��===2I����S4O62�������Ƶõ�Na2S��9H2O�����к���Na2S2O3��5H2O�����ʡ�Ϊ�ⶨ��Ʒ�ijɷ֣���������ʵ�飬�������£�
a. ȡ����10.00 g���500.00 mL��Һ��
b. ȡ������Һ25.00 mL�ڵ���ƿ�У��������ZnCO3����Һ��ȥNa2S���ˣ�����Һ�е���2��3�ε�����Һ����0.050 00 mol��L��1 I2��Һ�ζ����յ㣬��ȥ5.00 mL I2��Һ��
c. ��ȡ������Һ25.00 mL�ڵ���ƿ�У�����50.00 mL 0.050 00 mol��L��1��I2��Һ��������2��3�ε�����Һ�����ñ�Na2S2O3��Һ�ζ������I2����ȥ15.00 mL 0.100 0 mol��L��1 Na2S2O3��Һ��
������b����ZnCO3��ȥNa2S�����ӷ���ʽΪ____________��
���жϲ���c�еζ��յ�ķ���Ϊ______________��
������������Na2S��9H2O��Na2S2O3��5H2O��������������������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������֮��ͨ��һ����Ӧ��ʵ����ͼ��ʾת����ϵ�������������Ҳƥ�����( )
ѡ�� | X | Y | Z | ��ͷ��Ϊ��Ӧ�������Լ� |
|
A | Fe | FeCl2 | FeCl3 | ��ͨ������Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ����ͨCO2����ͨ����NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | �ۼ��� | |
D | NaAlO2 | Al(OH)3 | Al2O3 | �ܼ�ˮ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ѧ֪ʶ̽��Na2O2��H2�ܷ�Ӧ�����������װ��ͼ���ش��������⣺
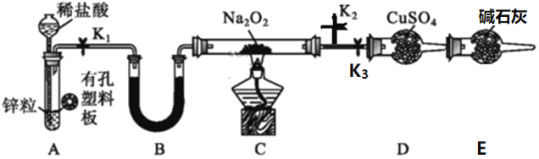
(1)װ��A�������Եļ�鷽����_______��A�з�����Ӧ�����ӷ���ʽΪ____________��
(2)Na2O2�ĵ���ʽΪ_______________��װ����װ����ͭ���������������__________��װ��B��ʢ�ŵ��Լ�����Ϊ__________��
(3)װ��E��������_____________��
(4)ʵ�����漰�����в���������ȷ��˳����____________��
�ٹر�K2����K1��K3����ȼC���ƾ��� ����K2���ڴ��ռ�һС�Թ������鴿
�۹ر�K3����K1��K2 ��װ����ȴ��ر�K1 ��Ϩ��C���ƾ���
(5)���۲쵽D��������й����������C�з�����Ӧ�Ļ�ѧ����ʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦNH4Cl+NaNO2![]() NaCl+N2��+2H2O�����Ҳ������壬�����ڶ���ʯ�Ϳ��ɡ����б�ʾ��Ӧ��������Ļ�ѧ������ȷ����
NaCl+N2��+2H2O�����Ҳ������壬�����ڶ���ʯ�Ϳ��ɡ����б�ʾ��Ӧ��������Ļ�ѧ������ȷ����
A. ������Ϊ18����ԭ�ӣ�![]()
B. N2�Ľṹʽ��N=N
C. Na+�Ľṹʾ��ͼ�� 
D. H2O�ĵ���ʽ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Դ�������ָ��Ӧ��֮һʹ�� ��Ӧ���ʼӿ�����á���ϡ�����ữ��![]() ������������ʵ�飬һ��ʱ�����Һ����ɫ��
������������ʵ�飬һ��ʱ�����Һ����ɫ��![]() ���Լ���
���Լ���![]() ����
����
ʵ��� | ʵ��� | ʵ��� |
|
|
|
��ɫ | ��ʵ�����ɫ�� | ��ʵ�����ɫ�� |
����˵������ȷ����
A.ʵ����з���������ԭ��Ӧ��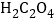 �ǻ�ԭ��������MnSO4�����Դ�����
�ǻ�ԭ��������MnSO4�����Դ�����
B.ʵ�����ɫ�Ȣٿ죬����ΪMnSO4�Ĵ����üӿ��˷�Ӧ����
C.ʵ�����ɫ�Ȣٿ죬����ΪCl-�Ĵ����üӿ��˷�Ӧ����
D.����![]() ��
��![]() ��ʵ��٣��Ʋ��ʵ�����ɫ��
��ʵ��٣��Ʋ��ʵ�����ɫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com