
(16分)为了研究某土壤样品的酸碱性,某同学25℃时做了如下实验:
①取m g土壤于烧杯中,加入VmL的蒸馏水,充分搅拌,静置后过滤,测定滤液的pH。
②向滤液中滴加氨水,每加入2 mL氨水就搅拌均匀并测量溶液的pH。
根据所得实验记录,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图如下:
利用上述记录的数据,回答下列问题:
(1)所测土壤显 性(填酸、碱、中)
(2)已知25℃时, 所用氨水的浓度= 6.0Í10-4mol/L,氨水的电离常数K = ,
为使该滤液呈中性,所加入氨水的恰当体积是 。
(4)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下列示意图中,曲线①是用NH3·H2O溶液滴定HCl溶液时,滴加NH3·H2O溶液体积与溶液电导率的关系。请你继续在该图中画出用NH3·H2O溶液滴定CH3COOH溶液时的曲线。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
试根据下述材料完成问题:
材料一:酸雨是英国化学家R.A.Smith 1872年最先提出的,一般是指pH小于5.6的雨、雪、雾等大气降水,是大气污染的表现。酸雨被称作“空中死神”。据某市区1998年环境状况公报载,市区酸雨频率为41.3%,比上年上升了5.5个百分点。降水的年平均pH为4.87,降水酸性污染较严重,表现为煤烟型污染特征。
材料二:①某地一场较大范围的酸雨使植物叶面遭到腐蚀,产生大量斑点而坏死,导致西瓜大面积绝产,损失惨重。②酸雨使植物阳离子从叶面析出,使钙、镁、铁等离子迅速从土壤中损失,土壤营养状况降低,还使光合作用受到抑制,影响植物的生长。③铝对生物来说是有害元素,在土壤中以氧化铝形式存在,pH=5.6时几乎不溶解。当pH为4.6时,铝的溶解度增加100倍,并转化成硫酸铝,造成树木死亡。四川某林场,华山松死亡率达96%,就是酸雨使土壤中硫酸铝浓度增高,危及华山松。
材料三:我国农业生产因遭受酸雨造成的损失每年高达15亿元。为了有效控制酸雨,国务院已经批准了《酸雨控制区和二氧化硫控制区划分方案》等规定。
某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水作水样进行测定,随时间的推移,多次测定该样品的pH,得到如下数据:
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
问题:①雨水样品放置时pH变化的主要原因(用化学方程式表示)_____________________;由此可以得出酸雨的形成过程可能是
______________________________________________。
②如果将刚取样的上述雨水和自来水相混合,pH将_________________ (填“增大”“减小”或“不变”),原因是__________________________________;二氧化硫表现_____________性。
(2)列举酸雨给人类造成的危害。
(3)你认为减少酸雨产生的途径可采取的下列措施是
__________________________________。
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①③ B.②③④⑤ C.①③⑤ D.①③④⑤
(4)为了减少煤燃烧时向大气排放的二氧化硫,不同的地方往往采取不同的“固硫”方法。
①火力发电厂常用Ca(OH)2的悬浊液吸收煤燃烧时产生的二氧化硫气体,并回收制得有用的石膏(CaSO4·2H2O),则有关反应的化学方程式_____________________,
__________________,___________________。
②硫酸工业常用浓氨水来吸收二氧化硫,则有关的化学方程式为_____________________。
③有些工业采取将生石灰和含硫煤混合使用。请写出燃烧时有关“固硫”反应的化学方程式。
④国际上最新采用“饱和亚硫酸钠溶液吸收SO2法”。请写出有关反应的化学方程式。
⑤请比较以上四种“固硫”方法的优缺点。
查看答案和解析>>
科目:高中化学 来源:2010届广州市高三理综化学测试卷 题型:实验题
(16分)为了研究某土壤样品的酸碱性,某同学25℃时做了如下实验:①取m g土壤于烧杯中,加入VmL的蒸馏水,充分搅拌,静置后过滤,测定滤液的pH。②向滤液中滴加氨水,每加入2 mL氨水就搅拌均匀并测量溶液的pH。根据所得实验记录,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图如下: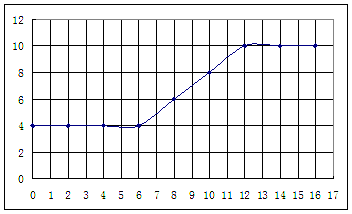
利用上述记录的数据,回答下列问题:(1)所测土壤显 性(填酸、碱、中)(2)已知25℃时, 所用氨水的浓度= 6.0Í10-4mol/L,氨水的电离常数K = ,为使该滤液呈中性,所加入氨水的恰当体积是 。(4)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下列示意图中,曲线①是用NH3·H2O溶液滴定HCl溶液时,滴加NH3·H2O溶液体积与溶液电导率的关系。请你继续在该图中画出用NH3·H2O溶液滴定CH3COOH溶液时的曲线。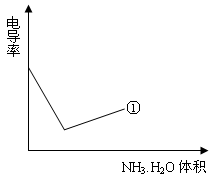
查看答案和解析>>
科目:高中化学 来源:2010届广州市高三理综化学测试卷 题型:实验题
(16分)为了研究某土壤样品的酸碱性,某同学25℃时做了如下实验:
①取m g土壤于烧杯中,加入VmL的蒸馏水,充分搅拌,静置后过滤,测定滤液的pH。
②向滤液中滴加氨水,每加入2 mL氨水就搅拌均匀并测量溶液的pH。
根据所得实验记录,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图如下:
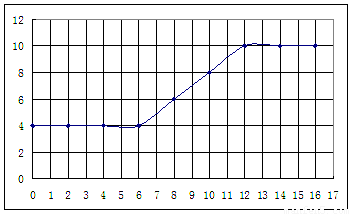
利用上述记录的数据,回答下列问题:
(1)所测土壤显 性(填酸、碱、中)
(2)已知25℃时, 所用氨水的浓度= 6.0Í10-4mol/L,氨水的电离常数K = ,
为使该滤液呈中性,所加入氨水的恰当体积是 。
(4)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下列示意图中,曲线①是用NH3·H2O溶液滴定HCl溶液时,滴加NH3·H2O溶液体积与溶液电导率的关系。请你继续在该图中画出用NH3·H2O溶液滴定CH3COOH溶液时的曲线。
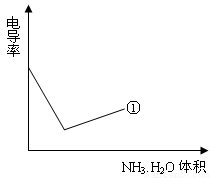
查看答案和解析>>
科目:高中化学 来源: 题型:
为了研究某土壤样品的酸
碱性,某同学25℃时做了如下实验:
①取m g土壤于烧杯中,加入VmL的蒸馏水,充分搅拌,静置后过滤,测定滤液的pH。
②向滤液中滴加氨水,每加入2 mL氨水就搅拌均匀并测量溶液的pH。
根据所得实验记录,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图如下:

利用上述记录的数据,回答下列问题:
(1)所测土壤显 性(填酸、碱、中)
(2)已知25℃时, 所用氨水的浓度= 6.0??10-4mol/L,氨水的电离常数K = ,
为使该滤液呈中性,所加入氨水的恰当体积是 。
(4)电导率是衡量电解质溶液导电能
力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下列示意图中,曲线①是用NH3·H2O溶液滴定HCl溶液时,滴加NH3·H2O溶液体积与溶液电导率的关系。请你继续在该图中画出用NH3·H2O溶液滴定CH3COOH溶液时的曲线。
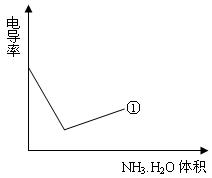
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com