
| A、H+、Na+、CO32-、Cl- |
| B、Ca2+、K+、S2-、ClO- |
| C、Fe2+、CO32-、Cl-、NO3- |
| D、HCO3-、Br-、OH-、SO42- |
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在100℃、101kPa条件下,1mol液态水气化时需要吸收40.69kJ的热量,则H2O(g)?H2O(l)的△H=+40.69kJ?mol-1 | ||||||||
| B、已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33kJ | ||||||||
C、H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1其它相关数据如表:
| ||||||||
| D、已知S(g)+O2(g)=SO2(s);△H1,S(g)+O2(g)=SO2(g);△H2,则△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解 过滤 蒸发结晶 |
| B、加热 溶解 过滤 |
| C、溶解 过滤 蒸馏 |
| D、溶解 过滤 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ?mol-1 |
B、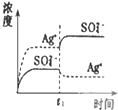 表示向Ag2SO4饱和溶液中加入等体积Na2SO4稀溶液,平衡会向左移动,Ksp减小 |
C、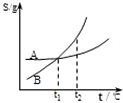 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中混有的乙烯的方法是通氢气在一定条件下反应,使乙烯转化为乙烷 |
| B、苯、溴苯在常温、常压下为无色且密度比水小的液体 |
| C、丙烯与2-丁烯都存在順反异构体 |
| D、苯不能与溴水发生加成反应,也不能被酸性KMnO4溶液氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B、在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C、在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D、在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B、装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ |
| C、装置③中插入海水中的铁棒,越靠近底端腐蚀越严重 |
| D、装置④中Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com