
(20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: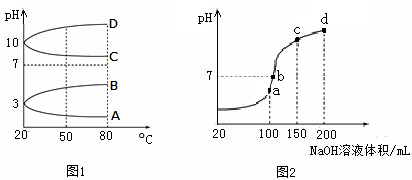
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH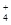 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH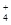 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
(20分)
Ⅰ、(1)2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O (2分) 0.3 (2分)
(2)Zn + 2OH- - 2e- = Zn(OH)2 (2分) 减小(2分)
Ⅱ、(1) 小于 (2分) (2)①A (2分) ②10-3-10-11 (2分)
(3)a (2分) c(Na+)>c(SO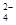 )>c(NH
)>c(NH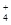 )>c(OH-)=c(H+) (2分)
)>c(OH-)=c(H+) (2分)
(4)能 (2分)
解析试题分析:Ⅰ、(1)KClO在KOH存在条件下,把Fe(OH)3氧化为K2FeO4,同时生成KCl、H2O,根据化合价升降法配平可得化学方程式:2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O;根据Fe元素化合价变化可得:K2FeO4 ~ 3e?,所以生成0.1molK2FeO4转移的电子的物质的量为0.3mol。
(2)放电时电池的负极发生氧化反应,元素化合价升高,根据总方程式可得放电时电池的负极反应式为:Zn + 2OH- - 2e- = Zn(OH)2,根据化学方程式,充电时消耗KOH,所以充电时电解液的pH减小。
Ⅱ、(1) NH4HSO4为强酸的酸式盐,电离出的H+抑制NH4+的水解,所以相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH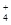 )小于 0.1 mol·L-1NH4HSO4中c(NH
)小于 0.1 mol·L-1NH4HSO4中c(NH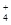 )。
)。
(2)①NH4Al(SO4)2中NH4+和Al3+水解使溶液显酸性,温度升高,水解程度增大,pH减小,故符合0随温度变化的曲线为A。
②根据示意图可知:20℃时,0.1 mol·L-1NH4Al(SO4)2pH为3,则c(H+)=10-3mol?L?1,c(OH?)= 10-11mol?L?1,根据电荷守恒可得:c(H+)+c(NH4+)+3c(Al3+)=c(OH?)+2c(SO42?),所以2c(SO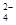 )-c(NH
)-c(NH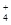 )-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
)-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
(3)a点显酸性,NH4+、Al3+水解,促进了H2O的电离,b点为中性,没有其它离子干扰,c、d显碱性,NaOH过量,抑制了H2O的电离,所以水的电离程度最大的是a;b点为中性,c(H+)=c(OH?),根据电荷守恒,c(Na+)+c(NH4+)=2c(SO42?),溶液显中性,NaOH应稍过量,抵消NH4+水解产生的H+,所以离子浓度由大到小顺序为:c(Na+)>c(SO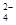 )>c(NH
)>c(NH )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
(4)溶液的pH=5,则c(OH?)=10-9mol?L?1,带入c(Al3+)?c3(OH?)= 2.0×10-33,解得c(Al3+)= 2.0×10-6mol?L?1,所以Al3+完全沉淀。
考点:本题考查氧化还原反应、电化学原理、盐类的水解、离子浓度比较、Ksp的应用。


科目:高中化学 来源: 题型:填空题
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 | Na+、Ba2+、NH4+ | 阴离子 | CO32-、Cl-、OH-、SO42- |
 = ;
= ;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分) 电池的发明和应用是化学家们对人类社会的重要贡献之一。
Ⅰ.每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如下图1所示。
(1)请写出从C口通入O2发生的电极反应式 。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在 的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为 (保留两位有效数字,NA取6.02×1023)。
Ⅱ.随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1)电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。请用离子方程式说明上述除杂的原理 。
(2)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为 。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg?L-1的废水,需用绿矾的质量为 kg。(写出主要计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
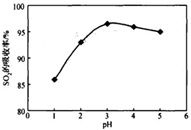
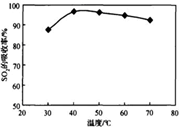
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下: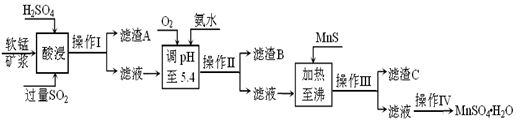
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
 CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。查看答案和解析>>
科目:高中化学 来源: 题型:问答题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: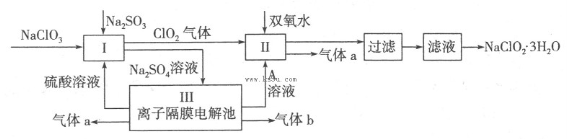
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.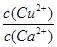 > >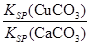 | D.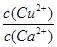 < <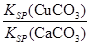 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
B、用待测定的溶液润洗碱式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a. 滴定操作的正确顺序是(用序号填写)___________________________ 。
b. 在G操作中如何确定终点? __________________________ ____ 。
c. 若换酚酞做指示剂,如何确定终点? _________________________ ____ 。
(2)氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL)[来 | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com