
铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
| A.Ksp(CuCO3)<Ksp(CaCO3) | B.c(Cu2+)<c(Ca2+) |
C.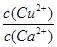 > >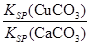 | D.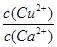 < <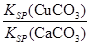 |
(14分)(1)Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s) (2分)
(2)Cu2O和Cu2S(1分);将气体通入品红溶液,溶液褪色,加热恢复原色(2分)
(3)①CO-2e-+CO32-=2CO2(2分) ②B(1分);Au、Ag以单质的形成沉积在阳极下方,Fe以Fe2+的形式进入电解液中(2分) ③增加3.2g(2分) (4)C(2分)
解析试题分析:(1)硫化铜的溶解度小于氯化锌的,所以根据沉淀容易向更难溶的方向转化可知,该反应的离子方程式是Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s)。
(2)根据反应的方程式可知,铜元素的化合价从+1价降低到0价,得到1个电子,S元素的化合价从-2价升高到+4价,失去6个电子,所以Cu2S是还原剂,Cu2O和Cu2S是氧化剂。SO2具有漂白性,能使品红溶液褪色,据此可以鉴别SO2,所以正确的操作是将气体通入品红溶液,溶液褪色,加热恢复原色。
(3)①原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此CO在负极通入,氧气在正极通入,即A电极是负极。由于电解质是一定比例的Li2CO3和Na2CO3熔融混合物为电解质,所以CO32-向负极移动,因此负极电极反应式是CO-2e-+CO32-=2CO2。
②粗铜精炼时,粗铜与电源的正极相连,做阳极,即与电极B相连。由于金属性是Au<Ag<Cu<Fe,所以阳极首先是铁失去电子,然后是铜失去电子,而Au和Ag形成阳极泥,所以Au、Ag、Fe它们在电解槽中的存在形式和位置为Au、Ag以单质的形成沉积在阳极下方,Fe以Fe2+的形式进入电解液中。
③准状况下1.12LCO的物质的量是1.12L÷22.4L/mol=0.05mol,反应中转移电子的物质的量是0.05mol×2=0.1mol,所以根据电荷守恒可知,精铜电极析出铜的物质的量是0.1mol÷2=0.05mol,即阴极精铜增加0.05mol×64g/mol=3.2g。
(4)向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,这说明溶液中c(Cu2+)·c(CO32-)>Ksp(CuCO3)、c(Ca2+)·c(CO32-)<Ksp(CaCO3),所以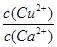 >
>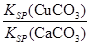 ,因此答案选C。
,因此答案选C。
考点:考查溶解平衡以及沉淀的转化;氧化还原反应的判断;SO2的检验;电极反应式的书写以及有关计算;粗铜的精炼等


科目:高中化学 来源: 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: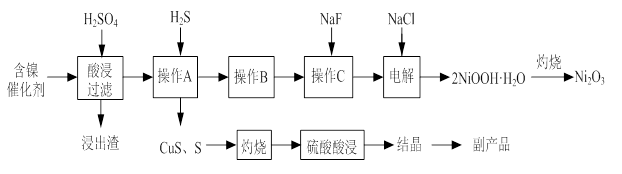
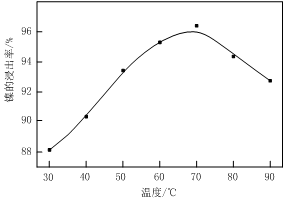
图Ⅰ 图Ⅱ
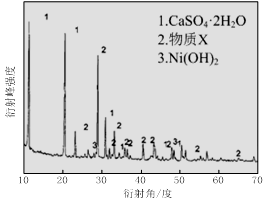
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题: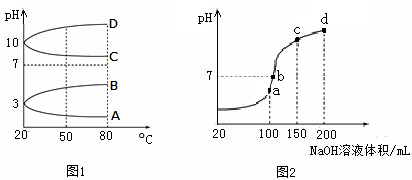
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH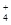 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH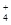 )。
)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO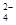 )-c(NH
)-c(NH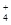 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某温度下,纯水电离出的c(H+)=2×10—7mol/L。
(1)该温度下,0.1mol/L 盐酸的PH= ,0.1mol/L NaOH溶液中的c(H+)=
(2)该温度下,pH=13的NaOH溶液中的c(OH—)是pH=11的NaOH溶液中的c (OH—)的 倍,若将两者以等体积混合,所得溶液pH值为 。(lg2=0.3,lg3=0.5,lg5=0.7)
(3)该温度下,等物质的量浓度的NaOH溶液与盐酸按3∶2体积比混合(不考虑混合时的体积变化),所得溶液的pH值为12,它们的浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.lxl0-10, KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________ 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 (填序号);
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O=H3PO3+_______。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-。
H++H2PO3-。
①某温度下,0.10mol?L-1的 H3PO3溶液 pH =1.6,即溶液中c(H+) =2.5×10-2 mol?L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7 (填“>”、“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为_______。
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如下:
①阴极的电极反应式为____________________________。
②产品室中反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)NH3在生活生产中用途广泛。
(1)下列关于NH3或氨水的实验能达到目的的是 (填编号)
| 编号 | A | B | C | D |
| 实验 装置 | 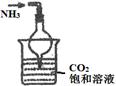 | 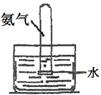 |  | 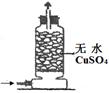 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |

| 实验步骤 | 实验目的 |
| 步骤1: ①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴 。 ② 。 ③ ,停止滴定,记录数据。重复测定2-3次。 | 测定氨水的准确浓度。 |
| 步骤2: ; | ; |
| 步骤3:通过计算得出氨水的电离常数。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验测定酸碱中和滴定曲线是高中化学的重要定量实验。下表是用0.10 mol/L的盐酸滴定 0.10 mol/L 20.00 mL NaOH 溶液时获得的一些相关数据。请回答下列问题:
(1)填写表中①②对应的 pH (结果保留两位小数)
(2)下图是本实验的滴定曲线图。请根据该图,说明强酸溶液滴定强碱溶液时,为什么既可以使用甲基橙作为指示剂,又可以使用酚酞试液作指示剂来指示滴定终点?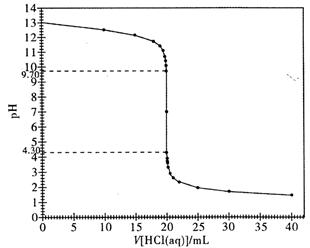
(3)若在滴定终点时俯视读数,最终测得的氢氧化钠溶液的浓度会 (填“偏大”、“偏小”或“没有影响”,下同);若滴定结束时,滴定管尖嘴悬有半滴标准盐酸,最终测得的氢氧化钠溶液的浓度会;若盛装待测液的锥形瓶洗涤干净后,未干燥即盛装待测液,最终测得的氢氧化钠溶液的浓度会 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
结合下图判断,下列叙述正确的是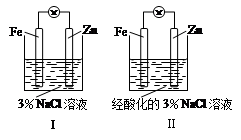
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是:Fe-2e-===Fe2+ |
| C.Ⅰ正极反应是:O2 + 2H2O + 4e-===4OH- |
| D.Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com