
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族;锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。
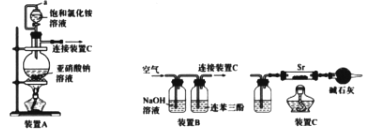
I.利用装置A和C制备Sr3N2
(1)写出由装置A制备N2的化学方程式_______。
(2)装置A中a导管的作用是_______。利用该套装置时,应先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,理由是__________。
II.利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(3)写出装置B的NaOH溶液中发生反应的离子方程式_________。
(4)装置C中广口瓶盛放的试剂是_________。
III.测定Sr3N2产品的纯度
(5)取ag该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是____。经改进后测得浓硫酸增重bg,则产品的纯度为_____(用相关字母的代数式表示)。
【答案】NH4Cl+NaNO2![]() N2↑+NaCl+2H2O 平衡气压,使液体顺利流下 利用生成的N2将装置内空气排尽 CO2+2OH-= CO32-+H2O 浓硫酸 未将气体中的水蒸气除去,也被浓硫酸吸收引起增重(或其他合理答案)
N2↑+NaCl+2H2O 平衡气压,使液体顺利流下 利用生成的N2将装置内空气排尽 CO2+2OH-= CO32-+H2O 浓硫酸 未将气体中的水蒸气除去,也被浓硫酸吸收引起增重(或其他合理答案) ![]() %
%
【解析】
I.利用装置A和C制备Sr3N2,装置A中NaNO2和NH4Cl反应制备N2,由于N2中混有H2O(g),为防止氮化锶遇水剧烈反应,故N2与Sr反应前必须干燥,装置 C中广口瓶用于除去N2中的H2O(g),碱石灰的作用是防止外界空气进入硬质玻璃管中。
II. 利用装置B和C制备Sr3N2,锶与镁位于同主族,联想Mg的性质,空气中的CO2、O2等也能与锶反应,为防止锶与CO2、O2反应,则装置B中NaOH用于吸收CO2,连苯三酚吸收O2,装置C中广口瓶用于除去N2中的H2O(g),碱石灰的作用是防止外界空气进入硬质玻璃管中。
III. 测定Sr3N2产品的纯度的原理为:Sr3N2+6H2O=3Sr(OH)2+2NH3↑、2NH3+H2SO4=(NH4)2SO4,根据浓硫酸增加的质量和浓硫酸的性质分析计算。
I.利用装置A和C制备Sr3N2
(1)NaNO2和NH4Cl反应制备N2,根据原子守恒还有NaCl、H2O生成,反应的化学方程式为NH4Cl+NaNO2![]() N2↑+NaCl+2H2O。
N2↑+NaCl+2H2O。
(2)装置A中a导管将分液漏斗上下相连,其作用是平衡气压,使液体顺利流下;锶与镁位于同主族,联想Mg的性质,空气中的CO2、O2等也能与锶反应,为防止装置中空气对产品纯度的影响,应先点燃装置A的酒精灯一段时间,利用生成的N2将装置内空气排尽,再点燃装置C的酒精灯。
II. 利用装置B和C制备Sr3N2
(3)锶与镁位于同主族,联想Mg的性质,空气中的CO2、O2等也能与锶反应,为防止锶与CO2、O2反应,则装置B中NaOH用于吸收CO2,反应的离子方程式为CO2+2OH-=CO32-+H2O。
(4)为防止氮化锶遇水剧烈反应,故N2与Sr反应前必须干燥,装置 C中广口瓶用于除去N2中的H2O(g),其中盛放的试剂为浓硫酸。
III.测定Sr3N2产品的纯度的原理为:Sr3N2+6H2O=3Sr(OH)2+2NH3↑、2NH3+H2SO4=(NH4)2SO4,故浓硫酸增加的质量为NH3的质量,由于浓硫酸具有吸水性,会将NH3中的水蒸气一并吸收,导致NH3的质量偏高,从而导致测得的产品纯度偏高。经改进后测得浓硫酸增重bg,根据N守恒,n(Sr3N2)=![]() n(NH3)=
n(NH3)=![]() ×
×![]() =
=![]() mol,则m(Sr3N2)=
mol,则m(Sr3N2)=![]() mol×292g/mol=
mol×292g/mol=![]() g,产品的纯度为
g,产品的纯度为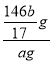 ×100%=
×100%=![]() ×100%。
×100%。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】t ℃时,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M2+),p(CO32-)=-lg c(CO32-)。ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A.线b表示BCO3的溶解平衡曲线
B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C.t ℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=10 0.9
BCO3(s)+A2+(aq)平衡常数K=10 0.9
D.向0.1 L 1 mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6 g时,B2+离子恰好沉淀完全(当B2+离子浓度为10-5 mol/L时认为沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;
元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;![]() 元素原子最外电子层上
元素原子最外电子层上![]() 、
、![]() 电子数相等;
电子数相等;![]() 元素的
元素的![]() 价阳离子的核外电子排布与氖原子相同;
价阳离子的核外电子排布与氖原子相同;![]() 元素原子的
元素原子的![]() 层有1个未成对的
层有1个未成对的![]() 电子。下列有关这些元素性质的说法一定正确的是( )
电子。下列有关这些元素性质的说法一定正确的是( )
A.![]() 元素的简单氢化物的水溶液显碱性
元素的简单氢化物的水溶液显碱性
B.![]() 元素的离子半径大于
元素的离子半径大于![]() 元素的离子半径
元素的离子半径
C.![]() 元素的单质在一定条件下能与
元素的单质在一定条件下能与![]() 元素的单质反应
元素的单质反应
D.![]() 元素的最高价氧化物在常温下不是气态
元素的最高价氧化物在常温下不是气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
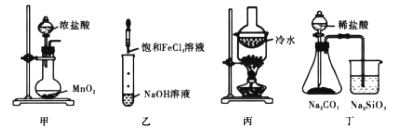
A.甲用于制取氯气
B.乙可制备氢氧化铁胶体
C.丙可分离I2和 KCl固体
D.丁可比较Cl、C、Si 的非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下 ,向 20.00mL 0. 1molL-1 BOH溶液中 滴入 0. 1 mo lL-1 盐酸 ,溶液中由水电离出的 c ( H+ ) 的负对数 [ - l gc水( H+ ) ] 与所加盐酸体积的关系如下图所示,下列说法正确的是
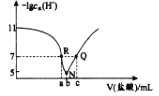
A.常温下,BOH的电离常数约为 1×10-4
B.N 点溶液离子浓度顺序:c(B+)>c(Cl-)> c( OH- )>c( H+)
C.a =20
D.溶液的pH: R > Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1,2-二溴乙烷,下列制备方案中最好的是( )
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.25℃时 pH=2 的 HF 溶液中,由水电离产生的 OH-浓度为 10-12 mol·L-1
B.0.1 mol·L-1 Na2CO3 溶液中:c(Na+)=c(HCO3 -)+c(H2CO3)+2c(CO32- )
C.向 1 L 1 mol·L-1 的 NaOH 热溶液中通入一定量 Br2,恰好完全反应生成溴化钠、次溴酸钠和溴酸钠(溴 酸为强酸、次溴酸为弱酸)的混合溶液:c(Na+)+c(H+)=6c(BrO3-)+2c(BrO-)+c(HBrO)+c(OH-)
D.25℃时 pH=3 的盐酸与 pH=11 的氨水等体积混合,所得溶液的 pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com