
【题目】t ℃时,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M2+),p(CO32-)=-lg c(CO32-)。ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是

A.线b表示BCO3的溶解平衡曲线
B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C.t ℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=10 0.9
BCO3(s)+A2+(aq)平衡常数K=10 0.9
D.向0.1 L 1 mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6 g时,B2+离子恰好沉淀完全(当B2+离子浓度为10-5 mol/L时认为沉淀完全)
【答案】D
【解析】
A. ACO3比BCO3溶解度更大,则ACO3的溶度积大于BCO3的溶度积,由图可知a的溶度积小于b的溶度积,所以线a表示BCO3的沉淀溶解平衡曲线,线b表示ACO3的沉淀溶解平衡曲线,A错误;
B. 在ACO3的饱和溶液中存在溶解平衡:ACO3(s)![]() A2+(aq)+CO32-(aq),加入Na2CO3溶液,溶液的体积增大,c(A2+)减小,c(CO32-)增大,c(A2+)·c(CO32-)不一定大于Ksp(ACO3),因此不一定产生沉淀,B错误;
A2+(aq)+CO32-(aq),加入Na2CO3溶液,溶液的体积增大,c(A2+)减小,c(CO32-)增大,c(A2+)·c(CO32-)不一定大于Ksp(ACO3),因此不一定产生沉淀,B错误;
C. 由选项A分析可知线a表示BCO3的沉淀溶解平衡曲线,线b表示ACO3的沉淀溶解平衡曲线,当pM=0时,p(CO32-)=2.2,则Ksp(ACO3)= c(A2+)·c(CO32-)=10-2.2,同理可知Ksp(BCO3)= c(B2+)·c(CO32-)=10-4,t℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=
BCO3(s)+A2+(aq)平衡常数K=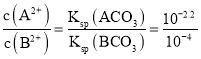 =101.8,C错误;
=101.8,C错误;
D. 由曲线a可知Ksp(BCO3)=c(B2+)·c(CO32-)=10-4,n(BCl2)=1 mol/L×0.1 L=0.1 mol,n(Na2CO3)=![]() =1.1 mol,二者按1:1反应产生BCO3沉淀后Na2CO3过量,剩余CO32-的物质的量为1.1 mol-0.1 mol=1 mol,c(CO32-)=
=1.1 mol,二者按1:1反应产生BCO3沉淀后Na2CO3过量,剩余CO32-的物质的量为1.1 mol-0.1 mol=1 mol,c(CO32-)=![]() =10 mol/L,则根据溶度积常数可知此时溶液中c(B2+)=
=10 mol/L,则根据溶度积常数可知此时溶液中c(B2+)=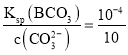 mol/L=10-5 mol/L,所以此时可认为B2+离子沉淀完全,D正确;
mol/L=10-5 mol/L,所以此时可认为B2+离子沉淀完全,D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:![]() (主要)
(主要)
正极:![]() (主要)
(主要)
下列说法不正确的是
A.钢铁在CO2水溶液中的腐蚀总反应可表示为![]()
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2的溶液其腐蚀性比相同pH值的HCl溶液腐蚀性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池充放电时总反应可表示为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
A.该电池可用H2SO4溶液作电解液
B.放电时,当有1molFe(OH)2生成时,电解质溶液中通过的电子数为2NA
C.放电时,Fe所在的电极发生还原反应
D.充电时,阳极的电极反应式为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物柴油是指由动植物油脂(脂肪酸甘油三酯)与醇(甲醇或乙醇)经酯交换反应得到的脂肪酸单烷基酯,可以替代普通柴油使用的清洁的可再生能源。某同学利用菜籽油与甲醇制备生物柴油,其原理及实验步骤:
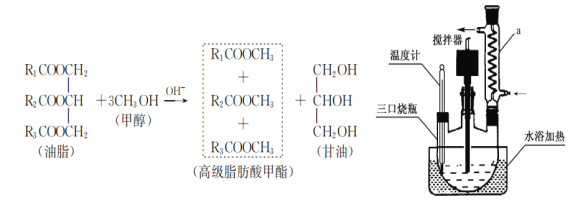
①称取4.6g CH3OH和0.2g NaOH依次放入锥形瓶中,充分震荡得NaOH溶液甲醇溶液;
②将20g 菜籽油、20g正己烷(作溶剂)、步骤1配得的NaOH甲醇溶液一次加入到三口烧瓶中;
③安装装置(如图)恒温水浴加热,使温度保持在60~65℃左右,搅拌速度400r/min,回流1.5h~2h;
④冷却、分液、水洗、回收溶剂并得到生物柴油。
回答下列问题:
(1)仪器a的名称是_________________ 。
(2)试验中取用的甲醇与油脂的物质的量之比约为6:1,甲醇过量的主要目的是________________;NaOH的用量不宜过多,其原因是____________________________。
(3)步骤4的液体分为两层,上层为生物柴油、正己烷和甲醇。下层主要为甘油、分离出下层液体的方法是_______________________________________ ;上层液体需用温水洗涤,能说明已洗涤干净的依据是____________________________________。
(4)碘值是指每100g油品所能吸收碘(I2)的质量。测定产品碘值得步骤如下:
I.准确称取m g 油品,注入碘量瓶中,向碘量瓶中加入20 mL氯仿溶解后,加入25.00mL韦氏碘液,(IBr溶液及催化剂,发生反应:![]() ),立即加塞,摇匀后,将碘量瓶放于黑暗处。
),立即加塞,摇匀后,将碘量瓶放于黑暗处。
II.30min 后立即加入20 mL 15%的碘化钾溶液和100 mL水,发生反应的化学方程式为 __________________________________________ ,不断震荡,用c mol·L-1 的Na2S2O3溶液滴定至溶液呈浅黄色时,加入1mL 淀粉指示剂,继续滴定(I2 + 2Na2S2O3=2NaI+Na2S4O6),至终点是消耗V1 mL Na2S2O3溶液。滴定终点的现象是 ______________________________________________ 。
III.另做空白对照试验,除不加油品外,其余操作同上,至终点时消耗V2 mL Na2S2O3溶液。则测得的油品的碘值为__________________ g/100g (列出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法错误的是

A.CO的催化氧化反应为2CO+O2=2CO2
B.反应路径1的催化效果更好
C.路径1和路径2第一步能量变化都为3.22 eV
D.路径 1 中最大能垒(活化能)E正 =1.77 eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在科技进步方面发挥着重要的作用。下列说法正确的是
A. 是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
B.2019世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC法能够实现直接从空气中捕获二氧化碳,该法可缓解全球日益严重的温室效应
D.以纯净物聚丙烯为原料生产的熔喷布口罩,在“新冠肺炎战疫”中发挥了重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族;锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。
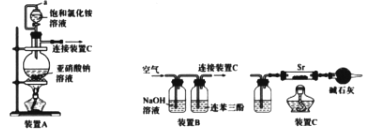
I.利用装置A和C制备Sr3N2
(1)写出由装置A制备N2的化学方程式_______。
(2)装置A中a导管的作用是_______。利用该套装置时,应先点燃装置A的酒精灯一段时间后,再点燃装置C的酒精灯,理由是__________。
II.利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(3)写出装置B的NaOH溶液中发生反应的离子方程式_________。
(4)装置C中广口瓶盛放的试剂是_________。
III.测定Sr3N2产品的纯度
(5)取ag该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是____。经改进后测得浓硫酸增重bg,则产品的纯度为_____(用相关字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com