
【题目】将羧酸的碱金属盐溶液用惰性电极电解可得到烃类化合物,例如:2CH3COOK+2H2O ![]() CH3CH3↑+2CO2↑+H2↑+2KOH现有下列衍变关系(A、B、C、D、E、F、G均为有机物): 回答下列问题:
CH3CH3↑+2CO2↑+H2↑+2KOH现有下列衍变关系(A、B、C、D、E、F、G均为有机物): 回答下列问题: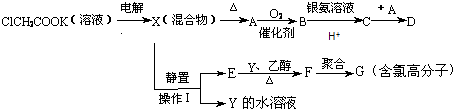
(1)电解ClCH2COOK溶液时阳极的电极反应式是(填选项).
A.2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑
B.2H++2e﹣=H2↑
C.2H2O+2e﹣=2OH﹣+H2↑
D.4OH﹣﹣4e﹣=2H2O+O2↑
(2)操作Ⅰ的名称是 , G的结构简式是 .
(3)写出B与银氨溶液按物质的量1:4反应的化学方程式: .
(4)写出下列化学方程式并指出其反应类型:A→B方程式: .
E→F方程式: .
指出反应类型:A→B , E→F .
【答案】
(1)A
(2)分液;![]()
(3)![]()
(4)HOCH2CH2OH+O2 ![]() OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应
OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应
【解析】解:由题目信息可知,电解ClCH3COOK溶液得到ClCH2CH2Cl、KOH混合溶液,加热ClCH2CH2Cl发生水解得到A为HOCH2CH2OH,乙二醇发生催化氧化生成B为OHC﹣CHO,乙二醛与银氨溶液发生氧化反应C为HOOC﹣COOH,乙二酸与乙二醇发生酯化反应生成D,ClCH2CH2Cl不溶于水,静置,分液得到Y为KOH,E为ClCH2CH2Cl,E在KOH、乙醇、加热条件下发生消去反应生成F,F发生加聚反应生成含氯高分子,则F为CH2=CHCl,G为 ![]() ,(1)电解ClCH2COOK溶液时,阳极发生氧化反应,ClCH2COO﹣在阳极放电生成ClCH2CH2Cl、CO2 , 阳极电极反应式为:2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑,故选:A;(2)ClCH2CH2Cl不溶于水,静置,分液得到Y为KOH,E为ClCH2CH2Cl,G的结构简式是
,(1)电解ClCH2COOK溶液时,阳极发生氧化反应,ClCH2COO﹣在阳极放电生成ClCH2CH2Cl、CO2 , 阳极电极反应式为:2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑,故选:A;(2)ClCH2CH2Cl不溶于水,静置,分液得到Y为KOH,E为ClCH2CH2Cl,G的结构简式是 ![]() ,所以答案是:分液;
,所以答案是:分液; ![]() ;(3)B为OHC﹣CHO,与银氨溶液按物质的量1:4反应生成C的化学方程式:
;(3)B为OHC﹣CHO,与银氨溶液按物质的量1:4反应生成C的化学方程式: ![]() , 所以答案是:
, 所以答案是: ![]() ;(4)A是HOCH2CH2OH,B是OHC﹣CHO,A→B是醇的催化氧化生成醛,所以方程式为:HOCH2CH2OH+O2
;(4)A是HOCH2CH2OH,B是OHC﹣CHO,A→B是醇的催化氧化生成醛,所以方程式为:HOCH2CH2OH+O2 ![]() OHC﹣CHO+2H2O,E是ClCH2CH2Cl,而F是CH2=CHCl,E→F是由饱和到不饱和,发生消去反应,方程式为:ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;A→B:氧化反应;E→F:消去反应;所以答案是:HOCH2CH2OH+O2
OHC﹣CHO+2H2O,E是ClCH2CH2Cl,而F是CH2=CHCl,E→F是由饱和到不饱和,发生消去反应,方程式为:ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;A→B:氧化反应;E→F:消去反应;所以答案是:HOCH2CH2OH+O2 ![]() OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应.
OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀,后沉淀溶解.这种溶液是( )
A. 稀硫酸 B. 饱和硫酸镁溶液 C. 氯化钠溶液 D. 饱和硫酸铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程如图1和实验装置如图2: 
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ , 步骤⑤ .
(2)写出步骤④对应反应的离子方程式:
(3)提取碘的过程中,可供选择的有机试剂是(填编号)
A.醋酸
B.苯
C.四氯化碳
D.酒精
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 .
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D为应用最广泛的金属,且D与甲的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。
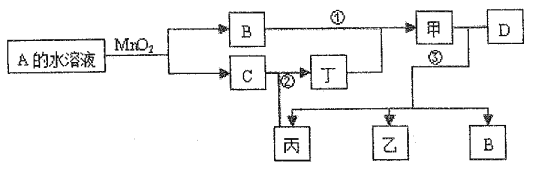
注:转化关系中,②表示C与丙反应生成丁。
(I)反应中MnO2的作用为_____,有1molA完全反应生成B、C转移____mol电子;
(II)若反应①除生成甲外,还生成丙,回答(1)、(2)小题:
(1)反应②的化学方程式:_______________。
(2)写出过量D与甲的稀溶液反应的离子方程式:____________。
(III)若丙为无色有刺激性气味的气体,可以使品红溶液褪色,回答(3)、(4)小题:
(3)写出下列化学方程式②:__________________;③(甲足量):_________________。
(4)检验乙溶液中离子的实验方法为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是( )
A.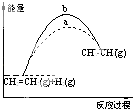 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
B.己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2 . 则△H1>△H2
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.在一定条件下,某可逆反应的△H=+100kJmol﹣1 , 则该反应正反应活化能比逆反应活化能大100kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 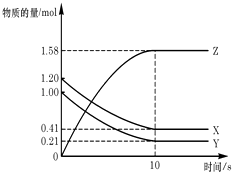
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15 g A物质和10.5 g B物质恰好完全反应,生成7.2 g C物质,1.8 gD物质和0.3 mol E物质,则E物质的摩尔质量是
A. 16.5 g/mol B. 111 g/mol C. 55 g/mol D. 27.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是:( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 验证FeCl3对H2O2分解反应有催化作用 | 验证单质氧化性: Cl2>Br2>I2 | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com