
ЁОЬтФПЁПФГЛЏбЇЪЕбщЪвВњЩњЕФЗЯвКжаКЌгаFe3+ЁЂCu2+ЁЂBa2+ЁЂClЉЫФжжРызгЃЌЯжЩшМЦЯТСаЗНАИЖдЗЯвКНјааДІРэЃЌвдЛиЪеН№ЪєВЂжЦБИТШЛЏБЕЁЂТШЛЏЬњОЇЬхЃЎ 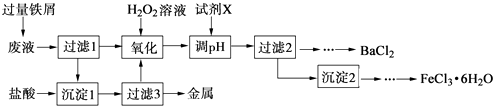
ЃЈ1ЃЉГСЕэ1жаКЌгаЕФН№ЪєЕЅжЪЪЧ ЃЎ
ЃЈ2ЃЉбѕЛЏЪБМгШыH2O2ШмвКЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ ЃЎ
ЃЈ3ЃЉЯТСаЮяжЪжаЃЌПЩвдзїЮЊЪдМСXЕФЪЧЃЈЬюзжФИЃЉЃЎ
A.BaCl2
B.BaCO3
C.NaOH
D.BaЃЈOHЃЉ2
ЃЈ4ЃЉМьбщГСЕэ2ЯДЕгЪЧЗёЭъШЋЕФЗНЗЈЪЧ ЃЎ
ЃЈ5ЃЉжЦБИТШЛЏЬњОЇЬхЙ§ГЬжаашБЃГжбЮЫсЙ§СПЃЌЦфФПЕФЪЧ ЃЎ
ЃЈ6ЃЉгЩЙ§ТЫ2ЕУЕНЕФТЫвКжЦБИBaCl2ЕФЪЕбщВйзївРДЮЮЊЁЂРфШДНсОЇЁЂЁЂЯДЕгЁЂИЩдяЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉЭЁЂЬњ
ЃЈ2ЃЉ2Fe2++2H++H2O2=2Fe3++2H2O
ЃЈ3ЃЉBD
ЃЈ4ЃЉШЁзюКѓвЛДЮЯДЕгвКЩйаэ,ЕЮШы1ЁЋ2ЕЮСђЫсФЦШмвК,ШєВЛГіЯжАзЩЋЛызЧ,БэУївбЯДЕгЭъШЋЃЎЃЈЛђШЁзюКѓвЛДЮЯДЕгвКЩйаэ,ЕЮШы1ЁЋ2ЕЮЯѕЫсвјШмвК,ШєВЛГіЯжАзЩЋЛызЧ,БэУївбЯДЕгЭъШЋЃЉ
ЃЈ5ЃЉвжжЦFe3+ЫЎНт
ЃЈ6ЃЉеєЗЂХЈЫѕЃЛЙ§ТЫ
ЁОНтЮіЁПНтЃКМгШыЕФЙ§СПЕФЬњаМЃЌгЩгкЬњЕФЛЏбЇаджЪБШЭЛюЦУЃЌвђДЫПЩвдАбН№ЪєЭДгбЮШмвКжажУЛЛГіРДЃЌЭЌЪБFe3+ФмбѕЛЏЕЅжЪЬњЩњГЩFe2+ЃЌвђДЫдкЙ§ТЫЕУЕНЕФГСЕэ1жаКЌгаЕФН№ЪєЕЅжЪЭЙ§СПЕФЬњЃЛТЫвККЌгаЖўМлЬњРызгЁЂБЕРызгЁЂТШРызгЃЌМгЫЋбѕЫЎНЋЖўМлЬњбѕЛЏГЩШ§МлЬњРызгЃЌдйМгМюЕїНкPHжЕЪЙШ§МлЬњРызгзЊБфГЩЧтбѕЛЏЬњГСЕэЖјГ§ШЅЃЌЫљвдГСЕэ2ЮЊЧтбѕЛЏЬњЃЌНјвЛВНзЊЛЏГЩТШЛЏЬњОЇЬхЃЌЖјТЫвК2дђжЛЪЃТШЛЏБЕШмвКЃЌОЙ§еєЗЂХЈЫѕЃЌРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяНјвЛВНзЊЛЏГЩТШЛЏБЕЙЬЬхЃЛЃЈ1ЃЉЗЯвКжаКЌгаFe3+ЁЂCu2+СНжжН№ЪєРызгЃЌМгШыЙ§СПЕФЬњЗлКѓЃЌЭРызгБЛЛЙдГЩН№ЪєЭЃЌЫљвддкЕкЂйЕУЕНЕФГСЕэжаКЌгаН№ЪєЭКЭЙ§СПЕФЬњЃЌ
ЫљвдД№АИЪЧЃКЭЁЂЬњЃЛЃЈ2ЃЉИљОнвдЩЯЗжЮіЃЌбѕЛЏЪБМгШыH2O2ШмвКгыЖўМлЬњРызгЗЂЩњбѕЛЏЛЙдЗДгІЃЌЗДгІЕФРызгЗНГЬЪНЮЊЃК2Fe2++2H++H2O2=2Fe3++2H2OЃЌЫљвдД№АИЪЧЃК2Fe2++2H++H2O2=2Fe3++2H2OЃЛЃЈ3ЃЉИљОнвдЩЯЗжЮіЃЌМгЪдМСXЕїНкPHжЕЪЙШ§МлЬњРызгзЊБфГЩЧтбѕЛЏЬњГСЕэЖјВЛФмв§ШыаТЕФдгжЪЃЌЫљвдбЁBDЃЌЙЪбЁЃКBDЃЛЃЈ4ЃЉШЁзюКѓвЛДЮЯДЕгвКЩйаэЃЌЕЮШы1ЁЋ2ЕЮСђЫсФЦШмвКЃЌШєВЛГіЯжАзЩЋЛызЧЃЌБэУївбЯДЕгЭъШЋЃЎЃЈЛђШЁзюКѓвЛДЮЯДЕгвКЩйаэЃЌЕЮШы1ЁЋ2ЕЮЯѕЫсвјШмвКЃЌШєВЛГіЯжАзЩЋЛызЧЃЌБэУївбЯДЕгЭъШЋЃЎЃЉЃЌЫљвдД№АИЪЧЃКШЁзюКѓвЛДЮЯДЕгвКЩйаэЃЌЕЮШы1ЁЋ2ЕЮСђЫсФЦШмвКЃЌШєВЛГіЯжАзЩЋЛызЧЃЌБэУївбЯДЕгЭъШЋЃЎЃЈЛђШЁзюКѓвЛДЮЯДЕгвКЩйаэЃЌЕЮШы1ЁЋ2ЕЮЯѕЫсвјШмвКЃЌШєВЛГіЯжАзЩЋЛызЧЃЌБэУївбЯДЕгЭъШЋЃЎЃЉЃЛЃЈ5ЃЉвђЮЊТШЛЏЬњеєЗЂЪБЫЎНтЩњГЩвзЛгЗЂЕФТШЛЏЧтЃЌЫљвджЦБИТШЛЏЬњОЇЬхЙ§ГЬжаашБЃГжбЮЫсЙ§СПЃЌвжжЦFe3+ЫЎНтЃЌЫљвдД№АИЪЧЃКвжжЦFe3+ЫЎНтЃЛЃЈ6ЃЉИљОнвдЩЯЗжЮіЃЌТШЛЏБЕШмвКЃЌОЙ§еєЗЂХЈЫѕЃЌРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяНјвЛВНзЊЛЏГЩТШЛЏБЕЙЬЬхЃЛ
ЫљвдД№АИЪЧЃКеєЗЂХЈЫѕЃЛЙ§ТЫЃЎ


 аЁбЇЖсЙкABОэЯЕСаД№АИ
аЁбЇЖсЙкABОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПОнЭМЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉШєЩеБжаШмвКЮЊЯЁСђЫсЃЌдђЙлВьЕНЕФЯжЯѓЪЧ_______________ЃЌЕчСїБэжИеы____(ЬюЁАЦЋзЊЁБЛђЁАВЛЦЋзЊЁБ)ЃЌСНМЋЗДгІЪНЮЊЃКе§МЋ_______________ЃЛИКМЋ______________________ЁЃ
ЃЈ2ЃЉШєЩеБжаШмвКЮЊЧтбѕЛЏФЦШмвКЃЌдђИКМЋЮЊ________(ЬюMgЛђAl)ЃЌзмЗДгІЗНГЬЪНЮЊ______ЁЃ
ЃЈ3ЃЉУРЙњАЂВЈТогюжцЗЩДЌЩЯЪЙгУСЫвЛжжаТаЭзАжУЃЌЦфЙЙдьШчЯТЭМЫљЪОЃКAЁЂBСНИіЕчМЋОљгЩЖрПзЕФЬМПщзщГЩЁЃИУЕчГиЕФе§МЋЗДгІЪНЮЊЃК___________________________ЁЃ
 .
.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNAЮЊАЂЗќйЄЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A.1.5gМзЛљЃЈЉCH3ЃЉЫљКЌЕчзгЪ§ФПЮЊNA
B.БъзМзДПіЯТЃЌ11.2LБНжаКЌга1.5NA ИіЬМЬМЫЋМќ
C.ГЃЮТГЃбЙЯТЃЌ14 gввЯЉКЭБћЯЉЃЈC3H6ЃЉЕФЛьКЯЦјЬхжаЫљКЌдзгзмЪ§ЮЊ3NA
D.4.6 g Naгы100 mL1.0 mol/LДзЫсШмвКЗДгІЃЌзЊвЦЕчзгЪ§ФПЮЊ0.1NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪжаЃЌЮяжЪжЎМфЭЈЙ§вЛВНЗДгІОЭФмЪЕЯжЭМЪОБфЛЏЕФЪЧЃЈЁЁЁЁЃЉ
ЮяжЪБрКХ | ЮяжЪзЊЛЏЙиЯЕ | a | b | c | d |
Ђй |
| NO | NO2 | N2 | HNO3 |
Ђк | Na2O | Na2O2 | Na | NaOH | |
Ђл | FeCl2 | FeCl3 | Fe | CuCl2 | |
Ђм | Al2O3 | NaAlO2 | Al | AlЃЈOHЃЉ3 |
A.ЂйЂкЂл
B.ЂйЂлЂм
C.ЂлЂм
D.ЂкЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПPASNaЃЈЖўЫЎКЯЖдАБЛљЫЎбюЫсФЦЃЉЪЧПЙНсКЫвЉЃЌЦфНсЙЙМђЪНШчЭМЛЏКЯЮя1ЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ 
A.ЛЏКЯЮя1КЭЛЏКЯЮя2ОљФмЪЙЫсадKMnO4ШмвКЭЪЩЋ
B.ЛЏКЯЮя1ЕФКЫДХЙВеёЧтЦзВтГі5ИіЦзЗх
C.PASNaгызуСПбЮЫсЗДгІЩњГЩШчЩЯЭМЛЏКЯЮя2
D.ЭЈШызуСПCO2ФмНЋЭМЛЏКЯЮя3зЊЛЏЮЊPASNa
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЧыаДГігЩБНЩњГЩЯѕЛљБНЕФЛЏбЇЗНГЬЪН_________________ЃЌЗДгІРраЭЪЧ________ЁЃ
ЃЈ2ЃЉФГЭщЬўЯрЖдЗжзгжЪСПЮЊ72ЃЌЦфНсЙЙжажЛгавЛжжЧтдзгЃЌИУЭщЬўЕФНсЙЙМђЪНЮЊ_________ЃЌЯЕЭГУћГЦЮЊ__________________ЁЃ
ЃЈ3ЃЉвбжЊФГЬўФмЪЙфхЫЎКЭИпУЬЫсМиШмвКЭЪЩЋЃЌНЋ1molИУЬўКЭ1molфхЕФЫФТШЛЏЬМШмвКЭъШЋЗДгІЃЌЩњГЩ1ЃЌ2ЁЊЖўфхЖЁЭщЃЌдђЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЪЕбщаЁзщгћжЦШЁбѕЛЏЭВЂжЄУїбѕЛЏЭФмМгПьТШЫсМиЕФЗжНтЃЌНјааСЫШчЯТЪЕбщЃК
ЃЈвЛЃЉжЦШЁбѕЛЏЭ
ЂйГЦШЁ2 gCuSO4ЁЄ5H2OбаЯИКѓЕЙШыЩеБЃЌМг10 mLеєСѓЫЎШмНтЃЛ
ЂкЯђЩЯЪіCuSO4ШмвКжаж№ЕЮМгШыNaOHШмвКЃЌжБЕНВЛдйВњЩњГСЕэЃЌШЛКѓНЋЫљЕУЛьКЯЮязЊвЦЕНеєЗЂУѓЃЌМгШШжСГСЕэШЋВПБфЮЊКкЩЋЃЛ
ЂлНЋВНжшЂкЫљЕУЛьКЯЮяЙ§ТЫЁЂЯДЕгЃЌСРИЩКѓбаЯИБИгУЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉВНжшЂйЁЂЂлжабаФЅЙЬЬхЫљгУвЧЦїЕФУћГЦЪЧ__________________ЁЃ
ЃЈ2ЃЉВНжшЂлжаЯДЕгГСЕэЕФВйзїЪЧ____________________________________ЁЃ
ЃЈЖўЃЉжЄУїбѕЛЏЭФмМгПьТШЫсМиЕФЗжНтВЂгыЖўбѕЛЏУЬЕФДпЛЏаЇЙћНјааБШНЯгУЭМзАжУНјааЪЕбщЃЌЪЕбщЪБОљвдЩњГЩ25 mLЦјЬхЮЊзМЃЌЦфЫќПЩФмгАЯьЪЕбщЕФвђЫиОљвбКіТдЃЌЯрЙиЪ§ОнМћЯТБэЃК

ЪЕбщађКХ | KClO3жЪСП | ЦфЫќЮяжЪжЪСП | Д§ВтЪ§Он |
Ђм | 1.2g | ЮоЦфЫћЮяжЪ | |
Ђн | 1.2g | CuO 0.5g | |
Ђо | 1.2g | MnO2 0.5g |
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ3ЃЉЩЯЪіЪЕбщжаЕФЁАД§ВтЪ§ОнЁБжИ__________________ЁЃ
ЃЈ4ЃЉШєвЊжЄУїЪЕбщЂнжаИЩдяЙмФкЪеМЏЕФЦјЬхЪЧO2ЃЌПЩД§ЦјЬхЪеМЏНсЪјКѓЃЌгУЕЏЛЩМаМазЁBжаШщНКЙмЃЌАЮШЅИЩдяЙмЩЯЕЅПзЯ№ЦЄШћЃЌ____________________________________ЁЃ
ЃЈ5ЃЉЮЊЬНОПCuOдкЪЕбщЂнжаЪЧЗёЦ№ДпЛЏзїгУЃЌашВЙзіШчЯТЪЕбщЃЈЮоашаДГіОпЬхВйзїЃЉЃКaЁЂ_________________________________ЃЛbЁЂCuOЕФЛЏбЇаджЪгаУЛгаИФБфЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯИАћжаКЌСПМЋЩйЕФЛЏбЇдЊЫигаЃЈ ЃЉ
A. FeЁЂMnЁЂZnЁЂMg B. ZnЁЂCuЁЂMnЁЂCa
C. ZnЁЂCuЁЂBЁЂFe D. MgЁЂMnЁЂCuЁЂMo
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭъГЩЯТСаЗДгІЛЏбЇЗНГЬЪНЃК
ЃЈ1ЃЉгУТШввЯЉжЦОлТШввЯЉЃЛ
ЃЈ2ЃЉЪЊЗЈСЖЭЃЛ
ЃЈ3ЃЉгУCOЛЙдГрЬњПѓЃЈFe2O3ЃЉвБСЖЬњЃЛ
ЃЈ4ЃЉгУТСЗЏЭСЃЈAl2O3ЃЉвБСЖТСЃЛ
ЃЈ5ЃЉЖЁЭщСбНтЛёЕУввЯЉ ЃЎ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com