
【题目】PASNa(二水合对氨基水杨酸钠)是抗结核药,其结构简式如图化合物1所示,下列说法正确的是( ) 
A.化合物1和化合物2均能使酸性KMnO4溶液褪色
B.化合物1的核磁共振氢谱测出5个谱峰
C.PASNa与足量盐酸反应生成如上图化合物2
D.通入足量CO2能将图化合物3转化为PASNa
【答案】AD
【解析】解:A.化合物1和化合物2分子中都含有酚羟基,二者都能够与酸性高锰酸钾溶液氧化,所以二者均能使酸性KMnO4溶液褪色,故A正确;
B.化合物1分子中含有6种等效H,则其核磁共振氢谱测出6个谱峰,故B错误;
C.PASNa与足量盐酸反应,化合物1中﹣COONa会转化成﹣COOH,无法转化成化合物2,故C错误;
D.根据强酸制取弱酸原理,向化合物的溶液中通入足量CO2,可以将图化合物3转化为PASNa,故D正确;
故选AD.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )

A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化和吸水
C.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
D.石蕊层为三层环,由上而下是蓝、紫、红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下面列举了一些化学键的键能数据,供计算使用
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
键能/kJ.mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g),该反应的逆反应的△H为 ( )
A. ﹣236 kJmol﹣1 B. ﹣412 kJmol﹣1 C. +236 kJmol﹣1 D. +412 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。
)。
某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见右图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O,恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是__________________________________________。
(4)高温燃烧可将水样中的碳酸盐、碳酸氧盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;____________________________________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl﹣四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体. 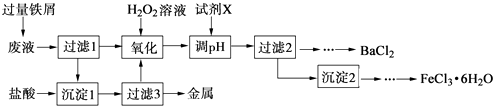
(1)沉淀1中含有的金属单质是 .
(2)氧化时加入H2O2溶液发生反应的离子方程式为 .
(3)下列物质中,可以作为试剂X的是(填字母).
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是 .
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 .
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为、冷却结晶、、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成 ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.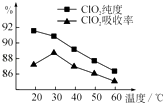
(1)据图可知,反应时需要控制的适宜温度是℃,要达到此要求需要采取的措施是 .
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO3﹣氧化成SO42﹣ , 请写出制备二氧化氯(ClO2)的离子方程式: .
(3)该校化学学习小组拟以“ ![]() ”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大地推进了科学的发展。门捷列夫对化学的贡献在于( )
A.提取了治疟药物青蒿素
B.开发了合成氨的生产工艺
C.揭示了燃烧的本质
D.提出了元素周期律
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行着广泛研究。请回答:
(1)某课题组实现了在常温常压下,以氮气和液态水为原料制备氨气,同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(g) | H2O(l) |
△H /kJ·mol-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为能化剂,据图示判断,负极反应的催化剂为______(填“Q”或“R”);正极的电极反应式为_________________________________________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H=-1266kJ/mol
2N2(g)+6H2O(g)△H=-1266kJ/mol
将固定比例NH3和O2 的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
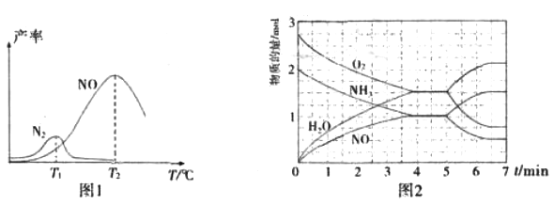
①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____________________________________。
③高于T2℃时,NO的产率降低的可能原因为______________(填选项字母)
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充人2molNH3和2.75molO2,发生反应
I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。
T2℃时,该反应的平衡常数K=________________;5min时,改变了某一外界条件,所改变的条件可能为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com