
����Ŀ����Ҫ�����
(1)�ǻ��ĵ���ʽ________________��
(2)��ʯ���ķ���ʽ___________��
(3)˳ʽ-2-��ϩ�Ľṹ��ʽ__________________��
(4)![]() ��ϵͳ����___________________________��
��ϵͳ����___________________________��
(5)д���ɼױ���TNT�ķ���ʽ_________________________________________
(6)2������1��3������ϩ������ʵ�����Br2�����ӳɷ�Ӧ�����������________��
(7)ij����ͬϵ�����Է���������92���ڹ����£�Cl2���Ժ��䷢��ȡ����Ӧ��ȡ���������Է���������126.5��д���÷�Ӧ����ʽ_________________________________
(8)���鼺ϩ���Ƿ���мױ����Լ���________________________________________
���𰸡�![]() C2H2
C2H2 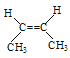 4������2���һ���1����ϩ
4������2���һ���1����ϩ 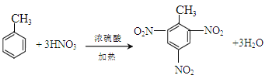 3 �ױ���������Ӧȡ�����ϵ�һ���� ��ˮ(��������Ȼ�̼)���������Һ
3 �ױ���������Ӧȡ�����ϵ�һ���� ��ˮ(��������Ȼ�̼)���������Һ
��������
(1)��Oԭ����H����γ�һ�Թ��õ��Ӷԣ��ǻ��ĵ���ʽ��![]() ��
��
(2)��ʯ���ǵ�ʯ(��Ҫ�ɷ���CaC2)��ˮ������Ӧ������Ȳ���壬����ʽ��C2H2��
(3)������ϩ��ƽ����ӣ�������̼̼˫����̼���֮��ļн���180�㣬˳ʽ-2-��ϩ����������˫��ͬһ��������Hԭ����˫������һ��Ľṹ����ṹ��ʽ�� ��
��
(4)����̼ԭ�Ӽ۵�����4��ԭ����������Ҫѡ����̼̼˫�����ڵ����̼��Ϊ����������˫���Ͻ���һ�˸�̼����ţ����в�ͬ��ȡ����ʱ����д�ģ���д���ӵ�ȡ���������ƣ�����![]() ��ϵͳ������4������2���һ���1����ϩ��
��ϵͳ������4������2���һ���1����ϩ��
(5)�ױ���Ũ������Ũ�������ʱ���ڼ��������£�����ȡ����Ӧ�������������ױ���TNT����TNT�ķ�Ӧ����ʽΪ�� ��
��
(6)2������1��3������ϩ�ṹ��ʽΪCH2=C(CH3)-CH=CH2�������к���2����ͬ��̼̼˫����������ʵ�����Br2�����ӳɷ�Ӧʱ�����Է���1��2�ӳɣ�Ҳ���Է���1��4�ӳɡ���������̼̼˫����ͬ�����Է���1��2�ӳ�ʱ������2�֣�Ҳ���Է���1��4�ӳɣ��õ�1�ּӳɲ������2������1��3������ϩ������ʵ�����Br2�����ӳɷ�Ӧ�����������3�֣�
(7)���ݱ���ͬϵ�����ʽͨʽCnH2n-6����Է���������14n-6,��ij����ͬϵ�����Է���������92����14n-6=92,���n=7�����Ը������Ǽױ����ڹ����£�Cl2���Ժ��䷢�������ϵ�ȡ����Ӧ��ȡ���������Է���������126.5����126.5-92+1=35.5��֪��һ��ȡ��������Ը÷�Ӧ�ķ���ʽ�� ��
��
(8) ��ϩ�ͼױ������Ա����Ը��������Һ����������ϩ������ˮ������Ӧ���ױ����ܣ����Ҫ���鼺ϩ���Ƿ���мױ������ȼ�������ˮ(��������Ȼ�̼)��ʹ��ϩ��ַ����ӳɷ�Ӧ���ų�̼̼˫���ĸ��ţ�Ȼ�����������Ը��������Һ����ױ������������Ը��������Һ��ɫ��ȥ��֤�����мױ��������мױ�����˼��鼺ϩ���Ƿ���мױ����Լ�����ˮ(��������Ȼ�̼)���������Һ��


 ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2-��������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2-�������顣���з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����

����д���пհ�:
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ____________��
��2��д���Ʊ�1��2-��������Ļ�ѧ����ʽ��____________��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е�����___________________��
��4������c��NaOH��Һ�������ǣ�_________________��
��5�������������������������ѣ�����_______________________�ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ŷŵ���ˮֻ���ܺ�Na+��K+��NH4+��Mg2+��Fe3+��SO32-��SO42-��Cl-�еļ��֣�������ˮ���������H+��OH-����������ƽ���ֳɼס��ҡ�����l00mL���ݣ�ÿ�ξ������������Լ����������ʵ�顣����˵����ȷ���ǣ� ��

A. ��ˮ���ܺ���Na+��K+��Fe3+
B. ���ܴ��ڵ���������ɫ��Ӧ��һ������ȷ��
C. ��ˮһ������Cl-��SO42-��Mg2+����c(Cl-)=0.2mol��L-1
D. ��ˮһ������ SO32-��Cl-��NH4+��Na+��K+��Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʹ�õĽ���֮һ�����������仯������й�֪ʶ���ش���������:
��1���������Ͻ��������еij��ò��ϣ����������У���ȷ����________��
A.����Ӳ�ȱ�������
B.������ʴ��ǿ����������
C.����������Ͻ�ֻ������Ԫ��
D.����һ�������¿���ˮ������Ӧ
E.�������Ũ�����жۻ�
��2�����ˮ����μ�1mol/LFeCl3��Һ����Һ������ĺ��ɫ���÷�Ӧ�����ӷ���ʽΪ____________���γɸ÷�ɢϵ����ֱ����Χ��_________��
��3�����ӹ�ҵ����30%FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�塣��д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ_________�����Ӹ�ʴ��ķ�Һ�л���ͭ�����»��FeCl3��Һ�����������Լ����������������ۡ���Ũ���ᡢ��Ũ���ᡢ���ռ��Ũ��ˮ�������õ���һ���Լ���__________��
A. �٢ڢ� B. �٢ۢܢ� C. �ڢܢ� D. �٢ܢ�
��4����������Na2FeO3��һ�����;�ˮ����
�ٸ���������Ҫͨ�����·�Ӧ��ȡ:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,��X�Ļ�ѧʽΪ__________��
�ڸ���������ˮ�п��Է������·�Ӧ��FeO42-+10H2O=4Fe(OH)3+8OH-+3O2���ɴ˿��������������ܹ�ɱ����������Ϊ������_____�ԣ����ܹ���ȥˮ������������Ϊ________��
����������������ˮ������_________��
a.KAl(SO4)2��12H2O b.�ۺ�������[Fe(OH)(SO4)]n c.ClO2 d.��84����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.05molCH3COONa��������ˮ���100mL��Һ������Һ�м����������ʳ�ֻ�Ϻ��йؽ��۲���ȷ���ǣ� ��
��������� | ���� | |
A | 0.05molCH3COONa���� |
|
B | 0.05molNaHSO4���� | c��CH3COO����+c��CH3COOH��=c��Na+����c��SO42���� |
C | 0.05molNH4Cl���� | ˮ����̶����� |
D | 50mLH2O | ��ˮ�������c��H+����c��OH������С |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��Կ��淴ӦA(g)+2B(g)![]() 3C(g)�����������У���˵����Ӧ�Ѵﵽƽ����ǣ� ��
3C(g)�����������У���˵����Ӧ�Ѵﵽƽ����ǣ� ��
A. C���ɵ�������C�ֽ���������
B. ��λʱ��������amolA��ͬʱ����3amolC
C. �����ڵ�ѹǿ���ٱ仯
D. �����������ʵ������ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������������Ʊ��������������й����ʵ�����������±���
������ | ��Է������� | �ܶ� /g��cm-3 | �е� /�� | �ܽ�� /100gˮ |
������ | 74 | 0.80 | 118.0 | 9 |
������ | 60 | 1.045 | 118.1 | ���� |
���������� | 116 | 0.882 | 126.1 | 0.7 |

�������£�
����50mL������ƿ�У�����18.5mL��������13.4mL�����ᣬ3-4��Ũ���ᣬͶ���ʯ����װ��ˮ��![]() ���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ
���ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ![]() ���¶ȼƼ����������ܡ�
���¶ȼƼ����������ܡ�
�ڽ���ˮ���ֳ�������ͷ�ӦҺһ�����Һ©���У�ˮϴ��10%Na2CO3��Һϴ�ӣ���ˮϴ�����ת������ƿ�����
�۽�����������������������ƿ�У���ѹ�����ռ���֣��õ�15.1g������������
��ش��й����⣺
��1����ˮӦ�ô�������___(����a������b��)�˹ܿ�ͨ�룻
��2����Ӧ��Ũ�����������___��
��3�����������10%Na2CO3��Һϴ���л��㣬�ò�����Ŀ����___��
��4�����з�Һ����ʱ��ʹ�õ�©����___(��ѡ��)��

��5��������ڽ����������ʱ������118�濪ʼ�ռ���֣�����ƫ__������������������)��ԭ��__��
��6����ʵ������У����������������IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AG��ʾ��Һ����ȣ������ʽΪ��AG=lg[ ]�������£�ʵ��������0.10mol/L��������Һ�ζ�10mL0.10mol/LMOH��Һ���ζ�������ͼ��ʾ������˵����ȷ������ ��
]�������£�ʵ��������0.10mol/L��������Һ�ζ�10mL0.10mol/LMOH��Һ���ζ�������ͼ��ʾ������˵����ȷ������ ��

A. MOH���뷽��ʽ��MOH=M++OH-
B. C�������������Ϊ10mL
C. ��B������������Һ���Ϊ5mL��������Һ�У�c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. �ζ������д�A�㵽D����Һ��ˮ�ĵ���̶�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧ���ʵ�˵����ȷ���ǣ�
A. ����Ƭ��ϡ���ᷴӦ������ʱ������98%��������Լӿ췴Ӧ����
B. 100 mL 2 molL��1�������пƬ��Ӧ�������������Ȼ�����Һ����Ӧ���ʲ���
C. ��ӦC(s)��H2O(g) ![]() CO(g)��H2(g)��һ�ɱ��ݻ����ܱ������н��У�����C���� , �䷴Ӧ��������
CO(g)��H2(g)��һ�ɱ��ݻ����ܱ������н��У�����C���� , �䷴Ӧ��������
D. ����β���е�NO��CO���Ի�����Ӧ����N2��CO2����Сѹǿ��Ӧ���ʱ���:
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com