
【题目】如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1 , 一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题: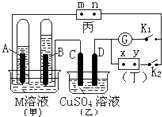
(1)M溶液可能是(填序号).
A.KCl溶液
B.Ba(OH)2溶液
C.KNO3溶液
D.CuCl2溶液
(2)乙池中盛有足量的硫酸铜溶液,D电极上的电极反应式为 , 此时向溶液中加入可以使溶液完全复原.
(3)滤纸丙上m点附近变为色,n点附近变为色,
(4)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1 , 断开K2 , 发现电流计G指针发生偏转,若M为硫酸溶液,写出B电极上发生的反应式 .
【答案】
(1)BC
(2)2H2O﹣4e﹣=4H++O2↑;0.16克CuO
(3)蓝;红
(4)O2+4e﹣+4H+=2H2O
【解析】解:A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml,A、B两极产生的气体体积之比为2:1,则A电极上生成氢气,B电极上生成氧气,所以A为阴极,B为阳极,x为正极,y为负极,(1)电解KNO3溶液、Ba(OH)2溶液溶液实际上是电解水,电解氯化钾溶液是电解氯化钾和水,电解氯化铜溶液生成氯气和铜,所以只有BC符合;所以答案是:BC;(2)D为阳极,发生氧化反应,电极方程式为2H2O﹣4e﹣=4H++O2↑,乙反应的化学方程式为2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,B极产生的气体体积为22.4mL,则n(O2)=0.001mol,转移0.004mol电子,由方程式可知生成0.001mol氧气,0.002mol铜,即生成0.002molCuO,应加入m(CuO)=0.001mol×80g/mol=0.16g, 所以答案是:2H2O﹣4e﹣=4H++O2↑;0.16克CuO;(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,所以m端滤纸变蓝,n为阴极,发生还原反应生成氢气和KOH,滴加酚酞溶液变红色,所以答案是:蓝;红;(4)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e﹣+4H+=2H2O,所以答案是:O2+4e﹣+4H+=2H2O.
2Cu+2H2SO4+O2↑,B极产生的气体体积为22.4mL,则n(O2)=0.001mol,转移0.004mol电子,由方程式可知生成0.001mol氧气,0.002mol铜,即生成0.002molCuO,应加入m(CuO)=0.001mol×80g/mol=0.16g, 所以答案是:2H2O﹣4e﹣=4H++O2↑;0.16克CuO;(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,所以m端滤纸变蓝,n为阴极,发生还原反应生成氢气和KOH,滴加酚酞溶液变红色,所以答案是:蓝;红;(4)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e﹣+4H+=2H2O,所以答案是:O2+4e﹣+4H+=2H2O.


科目:高中化学 来源: 题型:
【题目】将反应IO ![]() +5I﹣+6H+3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )
+5I﹣+6H+3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( ) 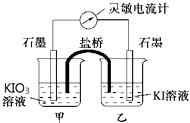
A.两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态
B.两次实验中,盐桥中的阳离子移动方向相反
C.开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝
D.向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用ClO2生产NaClO2并进行尾气处理的工艺如下:
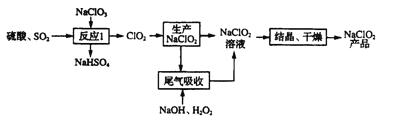
(1)写出“反应I”中生成ClO2的化学方程式:______
(2)“尾气吸收”是为了吸收未反应的ClO2,除减少污染外,还能______
(3)实验室用右图所示装置模拟“尾气吸收”过程,发现温度较低时吸收效果好,但该反应为放热反应。在不改变吸收液浓度和体积的条件下,欲使反应在0℃~5℃下进行,实验中可采取的措施有__________
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取1.000g上述产品,溶于水配成100.00ml,的溶液。
②取10.00mL待测液,加入过量的KI溶液,在酸性条件下发生如下反应:ClO2+4I-+4H+==2H2O+2I2+Cl-,杂质不与I-反应。
③以淀粉作指示剂,再加入0.2000mol/L Na2S2O3溶液,恰好完全反应时消耗Na2S2O3,溶液的体积为20.00mL。(已知:I2+2S2O32-=2I-+S4O62-)。计算该样品中NaClO2的纯度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2与石灰乳充分反应可以制取漂白粉,使用漂白粉作漂白剂比使用氯水更好的理由是
A.转变为易与水反应的物质 B.转变为较为稳定、便于贮存的物质
C.Ca(ClO)2比HClO漂白快 D.提高氯的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
(1)酸性锌锰干电池的负极反应为
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zng.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:①加入足量稀硫酸和溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为到之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写及说法正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890 kJ
B.C(s)+ ![]() O2(g)=CO(g)△H=﹣101.5 kJ?mol﹣1 , 该方程式的△H可表示碳的燃烧热
O2(g)=CO(g)△H=﹣101.5 kJ?mol﹣1 , 该方程式的△H可表示碳的燃烧热
C.Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=﹣2a kJ?mol﹣1 , 则任何强酸和强碱发生中和反应生成1mol H2O(l)的反应热均为﹣a kJ?mol﹣1
D.2mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)=H2(g)+ ![]() O2(g)△H=+242 kJ?mol﹣1
O2(g)△H=+242 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH﹣):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3﹣、CO32﹣ , 现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( ) 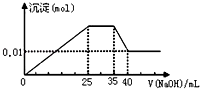
A.原溶液一定不存在H+、Cu2+、CO ![]()
B.不能确定原溶液是否含有K+、NO ![]()
C.原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D.实验所加的NaOH溶液浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的![]() 中,含有0.6NA个中子
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.2NA
C. 标准状况下,1.12L 的SO3所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸的一种合成路线如下:
(1)烃A的名称为 . 反应①中B的产率偏低,其原因是 .
(2)反应②的化学方程式为 .
(3)反应③的反应类型是 .
(4)肉桂酸的结构简式为 .
(5)反应③的产物同分异构体有多种,其中苯环上直接有一个甲基的酯类化合物有种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com