
【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中KIO3+5KI+3H2SO4═3I2+3H2O+3K2SO4
(1)改写成离子反应方程式后,并用双线桥表示该反应中电子转移的方向和数目:该反应中氧化产物与还原产物的质量比是 , 21.4gKIO3参加反应时转移电子mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是
A.Na2SO4溶液 B.酒精 C. CCl4 D.食盐水
所用的分离方法是 , 所用的玻璃仪器有 , 出现什么现象可以确定该食盐中含碘 .
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的稀硫酸溶液450mL,需用98%的浓硫酸(其密度为1.84g/cm3)mL,配制中需要用到的主要玻璃仪器是(填序号) .
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶
E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
【答案】
(1)5:1;0.5
(2)C;萃取分液;分液漏斗;静置分层后下层溶液为紫红色则说明有碘
(3)13.6;CEFGH
(4)ACD
【解析】解:(1)反应KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4的反应实质是IO3﹣+5I﹣+6H+═3I2+3H2O, 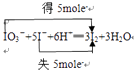 在此反应中,氧化产物与还原产物均为I2 , 且物质的量之比为5:1,故质量之比为5:1;反应中当有1molKIO3反应时,转移5mol电子,故当21.4g即0.1mol KIO3参加反应时转移电子0.5mol,
在此反应中,氧化产物与还原产物均为I2 , 且物质的量之比为5:1,故质量之比为5:1;反应中当有1molKIO3反应时,转移5mol电子,故当21.4g即0.1mol KIO3参加反应时转移电子0.5mol,
所以答案是: 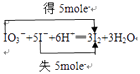 ;5:1;0.5;(2)I2在有机溶剂中的溶解度大于在水中的溶解度,故将I2从K2SO4溶液中分离,应采取萃取分液的方法来分离,使用的主要仪器是分液漏斗,选用的萃取剂的应同时满足以下要求:碘单质在萃取剂中的溶解度大于在水中的溶解度;萃取剂与水互不相溶;溶质、萃取剂和水三者间互不反应,故应选四氯化碳,萃取后,由于四氯化碳的密度比水大,故分液后碘的四氯化碳溶液在下层,呈紫红色,
;5:1;0.5;(2)I2在有机溶剂中的溶解度大于在水中的溶解度,故将I2从K2SO4溶液中分离,应采取萃取分液的方法来分离,使用的主要仪器是分液漏斗,选用的萃取剂的应同时满足以下要求:碘单质在萃取剂中的溶解度大于在水中的溶解度;萃取剂与水互不相溶;溶质、萃取剂和水三者间互不反应,故应选四氯化碳,萃取后,由于四氯化碳的密度比水大,故分液后碘的四氯化碳溶液在下层,呈紫红色,
所以答案是:C;萃取分液;分液漏斗;静置分层后下层溶液为紫红色则说明有碘;(3)设需要的浓硫酸的体积为VmL,根据溶液的稀释定律可知:0.5mol/L×0.5L×98g/mol=1.84g/cm3×VmL×98%,解得:V=13.6mL;
配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、移液、洗涤、定容、摇匀可知选用的仪器是50mL量筒、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故选CEFGH,所以答案是:13.6;CEFGH;(4)A.溶解后溶液没有冷却到室温就转移,则冷却后溶液体积偏小,则浓度偏高,故A选;
B.转移时没有洗涤烧杯、玻璃棒,会造成溶质的损失,则浓度偏低,故B不选;
C.向容量瓶加水定容时眼睛俯视液面,则溶液体积偏小,则浓度偏高,故C选;
D.用量筒量取浓硫酸后洗涤量筒,但洗涤液不能转移到容量瓶中,否则溶质偏多,则浓度偏高,故D选;
E.摇匀后发现液面低于刻度线是正常的,又加蒸馏水至刻度线则会造成浓度偏低,故E不选.
故选ACD.
【考点精析】解答此题的关键在于理解配制一定物质的量浓度的溶液的相关知识,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25℃),则下列说法(或关系式)正确的是( )
A. c(Na+)﹣c(X-)=9.9×10-7mol/L
B. c(Na+)= c(X-)+c(HX)= 0.2mol/L
C. 混合溶液中由水电离出的c(OH-)= 1×10-8mol/L
D. c(OH-)﹣c(HX)= c(H+)=1×l0-6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:

(1)甲烷燃料电池负极的电极反应为:____________________________。
(2)b电极上得到的气体是_______,电解氯化钠溶液的总反应方程式为 _____。
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为______L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:负极_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要除去Cl2中混有的少量气体HCl,最好的方法是将混合气体通过( )
A.饱和NaHCO3溶液B.饱和石灰水
C.饱和Na2CO3溶液D.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物中有一个C6H5﹣,一个﹣CH2﹣,一个﹣C6H4﹣,一个﹣OH,则该有机物中能使FeCl3溶液显紫色结构有( )
A.三种
B.四种
C.五种
D.六种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化, 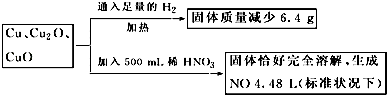
则转化过程中所加稀HNO3的物质的量浓度为( )
A.4.4 molL﹣1
B.3.6 molL﹣1
C.4.0 molL﹣1
D.3.2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
步 骤 | 现 象 |
Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
(1)为了证明沉淀变黑是AgCl转化为Ag2S的缘故,步骤I中NaCl溶液的体积范围为 .
(2)已知:25℃时Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2S)=6×10﹣30 , 此沉淀转化反应的平衡常数K .
(3)步骤V中产生的白色沉淀的化学式为 , 步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 .
(4)为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置. ①装置A中玻璃仪器有圆底烧瓶、导管和 , 试剂W为 .
②装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,B中试剂为 .
③实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化.
完成C中反应的化学方程式:
Ag2S+NaCl++AgCl+S+
C中NaCl的作用是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,被氧化与被还原的物质的物质的量之比为1:2的是( )
A.Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B.SO2+2H2S═3S+2H2O
C.3NO2+H2O═2HNO3+NO
D.3S+6KOH═2K2S+K2SO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84gcm﹣3)配制成浓度为0.5molL﹣1的稀硫酸500mL.
(1)所需仪器除烧杯,量筒,玻璃棒外,还需要实验仪器才能完成该实验.
(2)简要回答下列问题:①所需浓硫酸的体积为mL.②量筒量取浓硫酸后发现量筒内壁还附有硫酸,用水洗净量筒后将洗液一起转移至容量瓶,将使溶液浓度; (填“偏高”、“偏低”、“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com