
【题目】用2.0mol/L HCl溶液配制100mL 0.10mol/L HCl溶液,不需要的仪器是
A.![]() B.
B.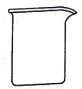 C.
C.![]() D.
D.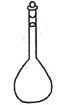
【答案】C
【解析】
用2.0mol/L HCl溶液配制100mL 0.10mol/L HCl溶液,用量筒量取5 mL2.0mol/L HCl溶液,将量筒量取的液体倒入烧杯中并加水稀释,并用玻璃棒搅拌,冷却至室温,将烧杯中的液体转移到容量瓶中,并洗涤烧杯、玻璃棒2~3次,并且将洗涤液转移到容量瓶中,然后加水,在离刻度线还有1~2cm时,改用胶头滴管加水定容。
A.由分析知,用量筒量取5 mL2.0mol/L HCl溶液,A不符合题意;
B.由分析知,将量筒量取的液体倒入烧杯中并加水稀释,B不符合题意;
C.用2.0mol/L HCl溶液配制100mL 0.10mol/L HCl溶液,用不到分液漏斗,C符合题意;
D.由分析知,用2.0mol/L HCl溶液配制100mL 0.10mol/L HCl溶液,用到容量瓶,D不符合题意;
答案选C。


科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:
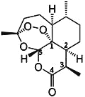
(1)组成青蒿素的三种元素电负性由小到大排序是_____,在基态O原子中,核外存在_____对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是_____(填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均采取sp3杂化
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
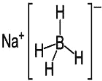
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH+B(OCH3)→3NaBH4+3CH3ONa
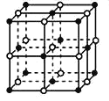
①NaH为_____晶体,如图是NaH晶胞结构,则NaH晶体的配位数是_____,若晶胞棱长为a,则Na原子最小核间距为_____。
②B(OCH3)3中B采用的杂化类型是_____。写出两个与B(OCH3)3具有相同空间构型的分子或离子_____。
③NaBH4结构如图所示,结构中存在的化学键类型有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫后的物质可以再生、再利用。
(1)一种干法脱硫技术以CuO为吸收荆,并用CH4再生CuO,原理如下:
2CuO(s)+2SO2(g)+O2(g)=2CuSO4(s) ΔH1=akJ·mol-1
2CuSO4(s)+CH4(g)=2Cu(s)+2SO2(g)+CO2(g)+2H2O(l) ΔH2=bkJ·mol-1
2Cu(s)+O2(g)=2CuO(s) ΔH3=ckJ·mol-1
反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=___kJ·mol-1(用含a、b、c的代数式表示)。
(2)钠碱法脱硫后的吸收液中主要成分为NaHSO3、Na2SO3。用三室阴阳膜组合膜电解吸收液可再生得到Na2SO3,原理如图1所示。
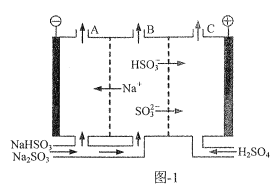
①写出电解时HSO3-在阳极发生反应的电极反应式:___。
②电解时采用吸收液低流速通过阴极的原因为___。
③如将阴离子交换膜电换成阳离子交换膜,则出口B溶液中的溶质主要是(填化学式)___。
(3)循环流化床烟气脱硫灰的主要成分有CaCO3、CaSO3·0.5H2O、CaSO3、CaSO4。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如图所示。
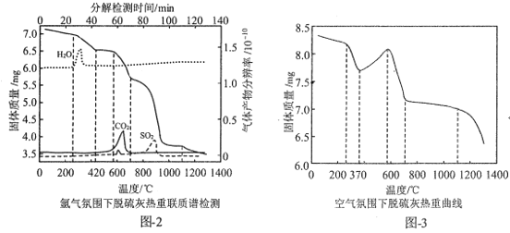
①图2中,1100℃时,残留固体主要成分为___;在600-630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少最的FeSO4分解导致的,写出该分解反应的化学方程式:___。
②对比图2与图3知,图3中370—42℃曲线上升的原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在科技进步方面发挥着重要的作用。下列说法正确的是
A. 是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
B.2019世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC法能够实现直接从空气中捕获二氧化碳,该法可缓解全球日益严重的温室效应
D.以纯净物聚丙烯为原料生产的熔喷布口罩,在“新冠肺炎战疫”中发挥了重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
氮原子可以形成 σ 键、π 键、大 π 键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下 列问题:
(1)第一电离能:氮______氧(填“大于”或“小于”),基态氮原子价电子排布图不是![]() ,是因 为该排布方式违背了__________。
,是因 为该排布方式违背了__________。
(2)肼(H2NNH2)分子中孤电子对与 σ 键的数目之比为______,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是______。
( 3)硝酸的结构可表 示 为 ![]() ,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
(4)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4 阴离子的空间构型为______,其中心原子杂化方式为______。
②分别写出一种与 Na3NO4 的阴离子互为等电子体的阴离子和分子______(填化学式)。
③在 573 K 条件下,实验室中用 NaNO3 和 Na2O 在银皿中反应制得 Na3NO4,Na2O 的立方晶胞如图所 示。

图中“●”表示______(填“Na+”或“O2”),距离“●”最近且等距离的“○”有______个,Na2O 晶胞的参数为 a pm,则晶胞密度为_____gcm3。(列出计算式即可,NA 为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取干燥氨气的装置如下图所示。下列相关叙述正确的是
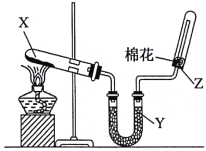
A.X处盛有的固体物质可以是NH4Cl
B.Y处盛有的固体物质可以是P2O5
C.将蘸有稀硫酸的玻璃棒靠近Z处时,有白烟产生,说明氨气已收集满
D.将湿润的红色石蕊试纸靠近Z处时,试纸变蓝,说明氨气已收集满
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。

已知:![]() +H2O
+H2O

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______,导管B除了导气外还具有的作用是_______________________。
②试管C置于冰水浴中的目的是_______________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填“上”或“下”),分液后用__________(填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_____口进入(填“f”或“g”)。蒸馏时要加入生石灰,目的是____________________________________。

③收集产品时,控制的温度应在_______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________(填字母序号,下同)。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒M和N,肯定属于同族元素且化学性质相似的是( )
A.结构示意图:M为![]() ,N为
,N为![]()
B.原子核外电子排布式:M为1s22s2,N为1s2
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
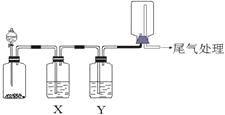
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com