
【题目】烟气脱硫后的物质可以再生、再利用。
(1)一种干法脱硫技术以CuO为吸收荆,并用CH4再生CuO,原理如下:
2CuO(s)+2SO2(g)+O2(g)=2CuSO4(s) ΔH1=akJ·mol-1
2CuSO4(s)+CH4(g)=2Cu(s)+2SO2(g)+CO2(g)+2H2O(l) ΔH2=bkJ·mol-1
2Cu(s)+O2(g)=2CuO(s) ΔH3=ckJ·mol-1
反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=___kJ·mol-1(用含a、b、c的代数式表示)。
(2)钠碱法脱硫后的吸收液中主要成分为NaHSO3、Na2SO3。用三室阴阳膜组合膜电解吸收液可再生得到Na2SO3,原理如图1所示。
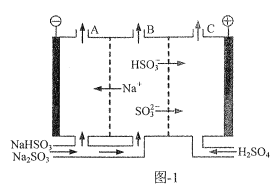
①写出电解时HSO3-在阳极发生反应的电极反应式:___。
②电解时采用吸收液低流速通过阴极的原因为___。
③如将阴离子交换膜电换成阳离子交换膜,则出口B溶液中的溶质主要是(填化学式)___。
(3)循环流化床烟气脱硫灰的主要成分有CaCO3、CaSO3·0.5H2O、CaSO3、CaSO4。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如图所示。
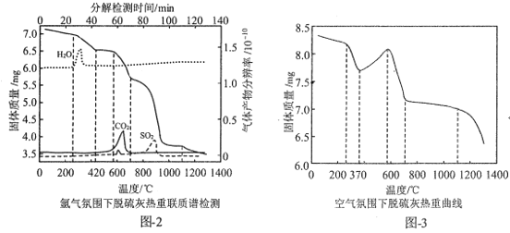
①图2中,1100℃时,残留固体主要成分为___;在600-630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少最的FeSO4分解导致的,写出该分解反应的化学方程式:___。
②对比图2与图3知,图3中370—42℃曲线上升的原因为___。
【答案】(a+b+c) ![]() -2e—+H2O===
-2e—+H2O===![]() +3H+ 使吸收液在阴极区充分反应,提高Na2SO3的再生率 NaHSO3和H2SO3 CaSO3、CaO 2FeSO4
+3H+ 使吸收液在阴极区充分反应,提高Na2SO3的再生率 NaHSO3和H2SO3 CaSO3、CaO 2FeSO4![]() Fe2O3+SO2↑+SO3↑ CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量
Fe2O3+SO2↑+SO3↑ CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量
【解析】
(1)根据盖斯定律可得,反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的ΔH=ΔH1 +ΔH2+ ΔH3 =(a+b+c),故答案为(a+b+c);
(2)①电解时HSO3-在阳极失去电子,生成![]() ,发生反应的电极反应式为:
,发生反应的电极反应式为:![]() -2e—+H2O===
-2e—+H2O===![]() +3H+,故答案为:
+3H+,故答案为:![]() -2e—+H2O===
-2e—+H2O===![]() +3H+;
+3H+;
②电解时采用吸收液低流速通过阴极可以使吸收液在阴极区充分反应,提高Na2SO3的再生率,故答案为:使吸收液在阴极区充分反应,提高Na2SO3的再生率
③阴离子交换膜电换成阳离子交换膜,则H+和Na+与![]() 结合,所以出口B溶液中的溶质主要是NaHSO3和H2SO3,故答案为:NaHSO3和H2SO3;
结合,所以出口B溶液中的溶质主要是NaHSO3和H2SO3,故答案为:NaHSO3和H2SO3;
(3)①1100℃时,残留固体主要成分为CaSO3、CaO,根据图像分析可得,FeSO4分解生成Fe2O3、SO2和SO3气体,反应式为2FeSO4![]() Fe2O3+SO2↑+SO3↑,故答案为:CaSO3、CaO;2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:CaSO3、CaO;2FeSO4![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
②因为CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量,所以370—42℃曲线上升,故答案为:CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加的质量。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
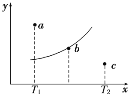
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料 PET 聚酯树脂和 PMMA 的合成路线如下:
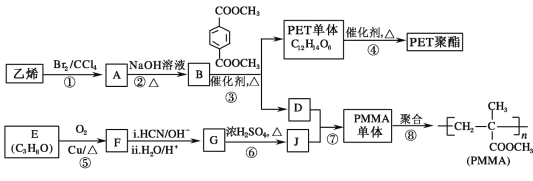
已知:Ⅰ.RCOOR′+R″18OH RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
II.  (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是_____________。
(2)②的化学方程式为____________。
(3)PMMA 单体的官能团名称是_____、_____。
(4)F 的核磁共振氢谱显示只有一组峰,⑤的化学方程式为:_________。
(5)G 的结构简式为______________。
(6)下列说法正确的是__________(填字母序号)。
a.⑦为酯化反应
b.B 和 D 互为同系物
c.D 的沸点比同碳原子数的烷烃高
d.1mol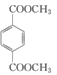 与足量 NaOH 溶液反应时,最多消耗 4 mol NaOH
与足量 NaOH 溶液反应时,最多消耗 4 mol NaOH
(7)J 的某种同分异构体与 J 具有相同官能团,且为顺式结构,其结构简式是:______。
(8)写出由 PET 单体制备 PET 聚酯并生成 B 的化学方程式:__________。
(9)写出⑦的化学方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中将含有较多Ca2+、Mg2+的水称为硬水。测定某水域的钙硬度、镁硬度(每升水中含Ca2+或Mg2+的质量,单位mg/L)的过程如下:
①取50.00mL水样,控制溶液的pH=10。以铬黑T为指示剂,用0.01000mol/LEDTA标准溶液滴定硬水中钙和镁的总含量至终点,消耗EDTA标准溶液30.00mL。
②另取50.00mL水样,加入10%NaOH溶液至pH=12.5,加入钙指示剂,用001000mol/LEDTA标准溶液滴定硬水中钙的含量至终点,消耗EDTA标准溶液20.00mL。
已知:Ca2+、Mg2+与EDTA反应的化学汁量比均为1:1。
(1)向硬水中加入石灰,可使Ca2+、Mg2+沉淀,以达到软化硬水的目的,写出Ca(OH)2和Ca(HCO3)2反应的化学方程式:___。
(2)“加入10%NaOH溶液至pH=12.5”的目的是___。
(3)计算该水样的钙硬度、镁硬度(写出计算过程)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对于溶液中一些成分的鉴定,正确的是
A.取少量待测液于试管中,滴加少量的NaOH溶液,若出现白色絮状,则说明待测液中含有![]()
B.取少量待测液于试管中,滴加少量的KSCN溶液,若出现血红色,则说明待测液中不含Fe元素
C.取少量待测液于试管中,滴加少量的![]() 溶液,若出现白色絮状,则说明待测液中含有
溶液,若出现白色絮状,则说明待测液中含有![]()
D.取少量待测液于试管中,滴加少量的NaOH溶液,若出现气泡,则说明待测液中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为了验证明矾的化学组成,进行了如下实验:
(1)把明矾的水溶液分别加入两试管中,用焰色反应,透过蓝色钴玻璃观察火焰为紫色,说明含有________________;
(2)在其中一个试管中,加入过量氨水,产生大量白色沉淀,将沉淀分为两部分,分别加入过量的盐酸和氢氧化钠,沉淀均消夫,说明明矾溶液中含____________(离子符号),写出白色沉淀和氢氧化钠溶液反应的离子方程式________________________________________________;
(3)在另一个试管中,加入盐酸酸化过的氯化钡溶液,产生白色沉淀,说明明矾溶液中含____________________________ (离子符号);
(4)明矾水溶液的pH值________7,其原因是________________________________ (离子方程式);明矾可以用作净水剂,其原因是____________________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中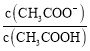 减小
减小
C.醋酸的电离程度增大,c(H+)也增大
D.溶液中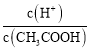 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com