
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
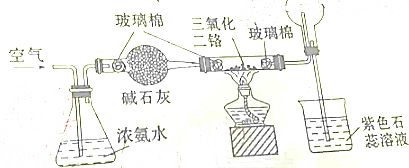
| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
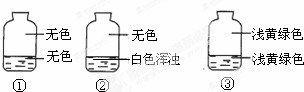 向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )| A. | AgNO3溶液、NaOH溶液、水 | B. | NaOH溶液、AgNO3溶液、水 | ||
| C. | 水、AgNO3溶液、NaOH溶液 | D. | AgNO3溶液、水、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com