
【题目】(1)现有下列4种物质:① NO、②浓H2SO4、③ NaHCO3、④SO2其中,遇空气变红棕色的是______(填序号,下同);能使蔗糖变黑的是______;能使品红溶液褪色的是_________。受热分解产生CO2的是______,写出该反应化学方程式_____________________;
(2)青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由"透闪石"和"阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2透闪石的化学式写成氧化物的形式为:________________________________;
(3)400 mL某浓度的NaOH溶液与5.6 L Cl2(标准状况)恰好完全反应,计算:生成的NaClO的物质的量_____________;该溶液中NaOH的物质的量浓度__________________;
(4)向1L,1mol/L的氯化铝溶液中加入含氢氧化钠xmol的氢氧化钠溶液,当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是_________________,当x=3.6时,Al(OH)3的质量为__________________________。
【答案】 ① ② ④ ③ 2NaHCO3![]() Na2CO3+H2O+CO2↑ 2CaO·5MgO·8SiO2·H2O 0.25 mol 1.25 mol·L-1 3 31.2g
Na2CO3+H2O+CO2↑ 2CaO·5MgO·8SiO2·H2O 0.25 mol 1.25 mol·L-1 3 31.2g
【解析】(1)NO遇空气变红棕色的NO2;浓硫酸具有脱水性,能使蔗糖变黑;二氧化硫具有漂白性,能使品红溶液褪色。碳酸氢钠受热分解产生CO2、水和碳酸钠,该反应化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;(2)根据金属活动顺序表结合化学式Ca2Mg5Si8O22(OH)2可知其氧化物的形式为2CaO·5MgO·8SiO2·H2O;(3)标准状况下5.6L氯气的物质的量是0.25mol,根据方程式Cl2+2OH-=Cl-+ClO-+H2O可知生成的NaClO的物质的量为0.25mol,消耗氢氧化钠是0.5mol,NaOH的物质的量浓度为0.5mol÷0.4L=1.25 mol·L-1;(4)氯化铝的物质的量是1mol,恰好全部转化为氢氧化铝时:Al3++3OH-===Al(OH)3↓,消耗氢氧化钠是3mol,恰好转化为偏铝酸钠时:Al3++4OH-=AlO2-+2H2O,消耗氢氧化钠是4mol,所以当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是3<x<4。当x=3.6时生成的氢氧化铝部分溶解,与氢氧化铝反应的氢氧化钠是3.6mol-3mol=0.6mol,根据方程式Al(OH)3+OH-===AlO2-+2H2O可知消耗氢氧化铝是0.6mol,剩余氢氧化铝是1mol-0.6mol=0.4mol,质量是0.4mol×78g/mol=31.2g。
Na2CO3+H2O+CO2↑;(2)根据金属活动顺序表结合化学式Ca2Mg5Si8O22(OH)2可知其氧化物的形式为2CaO·5MgO·8SiO2·H2O;(3)标准状况下5.6L氯气的物质的量是0.25mol,根据方程式Cl2+2OH-=Cl-+ClO-+H2O可知生成的NaClO的物质的量为0.25mol,消耗氢氧化钠是0.5mol,NaOH的物质的量浓度为0.5mol÷0.4L=1.25 mol·L-1;(4)氯化铝的物质的量是1mol,恰好全部转化为氢氧化铝时:Al3++3OH-===Al(OH)3↓,消耗氢氧化钠是3mol,恰好转化为偏铝酸钠时:Al3++4OH-=AlO2-+2H2O,消耗氢氧化钠是4mol,所以当铝元素以Al(OH)3和AlO2-形式存在时x的取值范围是3<x<4。当x=3.6时生成的氢氧化铝部分溶解,与氢氧化铝反应的氢氧化钠是3.6mol-3mol=0.6mol,根据方程式Al(OH)3+OH-===AlO2-+2H2O可知消耗氢氧化铝是0.6mol,剩余氢氧化铝是1mol-0.6mol=0.4mol,质量是0.4mol×78g/mol=31.2g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某种橡胶的分解产物为碳氢化合物,对这种碳氢化合物作如下实验:①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72g,再通过石灰水,石灰水增重2.2g.②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍.③该碳氢化合物0.1mol能和32g溴起加成反应.④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上.下列说法正确的是( )
A.该碳氢化合物为2﹣甲基﹣1,3﹣戊二烯
B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物
C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物
D.该碳氢化合物与足量氢气加成时可以生成正戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.煤、石油、天然气均为化石能源
B.化石燃料在燃烧过程中能产生污染环境的SO2等有害气体
C.直接燃烧煤不如将煤进行深加工后再燃烧效果好
D.化石能源是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列关于化学反应速率说法中不正确的是
A. 反应速率用于衡量化学反应进行的快慢
B. 决定反应速率的主要因素是反应物的性质
C. 可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D. 增大反应物的浓度、提高反应温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
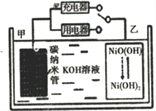
A. 充电时,电池的碳电极与直流电源的正极相连
B. 放电时,甲电极为负极,电极反应为: H2-2e═2H+
C. 充电时,乙电极反应式为:NiO(OH)+H2O+e═Ni(OH)2+OH
D. 电池总反应为H2+2NiO(OH)![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,静置,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为( )
A. 5.0 mol/L B. 2.0 mol/L C. 0.02mol/L D. 7.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣12H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:①电解池中X极上的电极反应式为;在X极附近观察到的现象是 .
②Y电极上的电极反应式为;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.52 克铜镁合金完全溶解于50mL、密度为1.400g/cm3、质量分数为63%的浓硝酸中,得到NO2气体3584mL(标准状况),向反应后的溶液中加入适量的1.0mo1/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 合金中铜和镁的物质的量相等
B. 加入NaOH溶液的体积是100mL
C. 得到的金属氢氧化物的沉淀为6.24 克
D. 浓硝酸与合金反应中起氧化性的硝酸的物质的量为0.16 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com