
| A. | Na2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 题中操作可证明Na2SO3溶液是否被氧化 | |
| D. | 此实验不能确定Na2SO3是否部分被氧化 |
分析 若Na2SO3被部分氧化,混有Na2SO4,加盐酸后排除Na2SO3的干扰,再利用钡离子检验即可;该实验中滴入Ba(NO3)2溶液,产生白色沉淀,白色沉淀可能为亚硫酸钡、硫酸钡的混合物,再加硝酸可氧化亚硫酸钡,以此来解答.
解答 解:A.取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀,硝酸根离子在酸溶液中具有氧化性,原溶液中可以是硫酸根离子或亚硫酸根离子,该实验不能说明部分氧化,故A错误;
B.若未被氧化,加入Ba(NO3)2溶液后,生成的沉淀为BaSO3,故B错误;
C.若未被氧化,加入Ba(NO3)2溶液后,生成的沉淀为BaSO3,再加入足量稀硝酸,充分振荡后,生成硫酸钡白色沉淀,该实验不能证明Na2SO3溶液是否被氧化,故C错误;
D.硝酸根离子在酸溶液中具有氧化性,原溶液中可以是硫酸根离子或亚硫酸根离子,此实验不能确定Na2SO3是否部分被氧化,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、离子检验等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:实验题

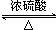 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
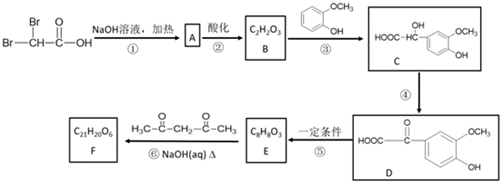
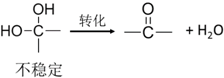

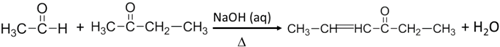
 .反应④的化学方程式是
.反应④的化学方程式是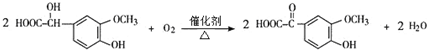 .
.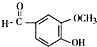 .F的结构简式是
.F的结构简式是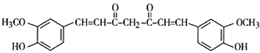 .
.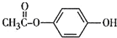 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
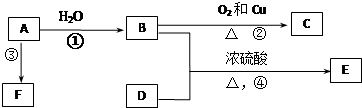
 ,该反应类型是取代反应.
,该反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
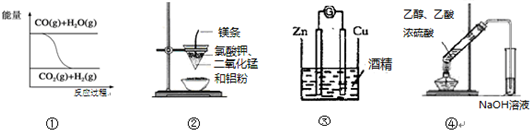
| A. | 图①表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| B. | 图②可以制取金属锰 | |
| C. | 图③形成原电池 | |
| D. | 图④制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为奇数的基态原子,其原子轨道中一定不含有“未成对电子” | |
| B. | 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
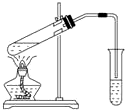 下列实验能获得成功的是( )
下列实验能获得成功的是( )| A. | 用如图所示装置,无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 | |
| C. | 水和乙醇的混合液,可用蒸馏的方法使其分离 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可观察到有银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
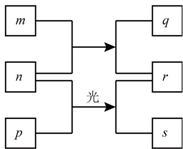 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液是一种常见的强酸,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液是一种常见的强酸,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com