
【题目】(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O(l),放出19.5 kJ热量(25 ℃时),表示N2H4燃烧的热化学方程式是____________________________ 。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4 mol液态肼和足量液态H2O2反应,生成氮气和液态水,放出327.05 kJ的热量。写出该反应的热化学方程式:__________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________________________________________。
(4)下图是一定量丙烷完全燃烧生成CO2 和1mol H2O (l)过程中的能量变化图。

写出表示丙烷燃烧热的热化学方程式:__________________________________。
【答案】N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1 N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1 N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1 C3H8(g)+5O2(g)=3CO2(g) +4H2O(l) ΔH=-2215.0 kJ·mol-1
【解析】
(1)1mol肼质量为32克,完全燃烧生成液态水放出19.5kJ×32=624kJ热量,据此书写热化学方程式;
(2)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
(3)先写出N2与H2反应生成NH3的化学反应方程式,再根据ΔH=反应物断键吸收的能量-生成物成键放出的能量,计算反应热,并写出热化学方程式;
(4)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,一般,C→CO2(g),S→SO2(g),H→H2O(l)。1mol 丙烷燃烧生成4mol水,根据丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热 △H=553.75kJ/mol,则1mol 丙烷完全燃烧生成液态水放出553.75kJ×4=2215.0kJ的热量,据此写出丙烷燃烧热的的热化学方程式。
(1)已知在101 kPa时,1 g N2H4在氧气中完全燃烧生成氮气和H2O(l),放出19.5 kJ热量(25 ℃时),则1mol肼完全燃烧生成液态水放出19.5kJ×32=624kJ热量,该反应的热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1;
故答案为:N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-624 kJ·mol-1;
(2)0.4mol液态肼和足量H2O2反应,生成氮气和液态水,放出327.05kJ的热量,则1mol液态肼与足量液态H2O2反应时放出的热量为![]() ,则该反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1;
,则该反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1;
故答案为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.625 kJ·mol-1;
(3)在反应N2+3H22NH3中,断裂3mol H-H键,1mol N![]() N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,则ΔH=反应物断键吸收的能量-生成物成键放出的能量=2254kJ-2346kJ=-92kJ,则该反应的热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1;
N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,则ΔH=反应物断键吸收的能量-生成物成键放出的能量=2254kJ-2346kJ=-92kJ,则该反应的热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1;
故答案为:N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1;
(4)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,一般,C→CO2(g),S→SO2(g),H→H2O(l)。1mol 丙烷燃烧生成4mol水,根据丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,反应放热 △H=553.75kJ/mol,则1mol 丙烷完全燃烧生成液态水放出553.75kJ×4=2215.0kJ的热量,则丙烷燃烧热的的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g) +4H2O(l) ΔH=-2215.0 kJ·mol-1;
故答案为:C3H8(g)+5O2(g)=3CO2(g) +4H2O(l) ΔH=-2215.0 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.次氯酸的电离方程式为:HClO = H+ + ClO-
B.c(H+)等于1×10-7mol·L-1的溶液一定是中性溶液
C.在CH3COONa溶液中,c(CH3COO-) < c(Na+)
D.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 HCl溶液中的c(H+)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1molL、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )

A. Ka(HX)>Kb(NH3·H2O)
B. b点时c(NH4+)>c(HX)>c(OH—)=c(H+)
C. a、b、d几点中,水的电离程度d>b>a
D. a →b点过程中,可能存在c(X—)<c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
(1)用物质A表示的反应速率为____。
(2)用物质B表示的反应速率为____。
(3)2s时物质B的转化率为_____。
(4)2s时物质A的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对
与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强。 请仔细阅读上述材料,回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO43-_____________________________; PCl5_____________________。
(2) 有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
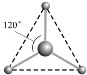 __________________;
__________________;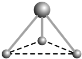 __________________。
__________________。
(3) 按要求写出第二周期非金属元素构成的中性分子的化学式:平面三角形分子___________,三角锥形分子___________,四面体形分子_____________。
(4) 下列一组微粒中键角由大到小顺序排列为____________________(用编号填写)
①HCN ②SiF4 ③SCl2 ④CO32- ⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com