
【题目】将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
(1)用物质A表示的反应速率为____。
(2)用物质B表示的反应速率为____。
(3)2s时物质B的转化率为_____。
(4)2s时物质A的浓度为_____。
【答案】0.3mol·L-1·s-1 0.15mol·L-1·s-1 30% 1.4 mol·L-1
【解析】
(1)根据C的平衡浓度计算C的生成速率,再根据反应速率之比等于化学计量数之比计算A消耗速率;
(2)根据C的平衡浓度计算C的生成速率,再根据反应速率之比等于化学计量数之比计算B消耗速率
(3)根据反应式计算B的平衡物质的量,转化率=![]() ×100%;
×100%;
(4)根据反应方程式计算2s时物质A的浓度;
(1)经2s后测得C的浓度为0.6mol/L,则C的生成速率为v(C)=![]() = 0.3mol·L-1·s-1,根据反应速率之比等于化学计量数之比,则v(A)=v(C)=0.3mol·L-1·s-1;
= 0.3mol·L-1·s-1,根据反应速率之比等于化学计量数之比,则v(A)=v(C)=0.3mol·L-1·s-1;
(2)v(B):v(C)=1:2,所以v(B)=0.15mol·L-1·s-1;
(3)4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)![]() 2C(g)
2C(g)
起始(mol)4 2 0
转化(mol)1.2 0.6 1.2
平衡(mol)2.8 1.2 1.2
则2s时物质B的转化率为![]() =30%。
=30%。
(4)根据(3)得出,2秒后,C(A)=![]() =1.4mol/L
=1.4mol/L


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】I.根据如图给出的装置图回答下列问题:
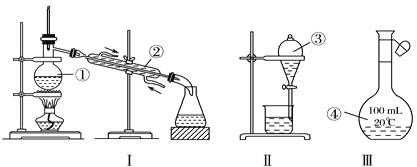
(1)写出图中玻璃仪器的名称:①____;②____;③_____。
(2)①~④中,使用前必须检查是否漏水的是___、___(填仪器序号),分离溴水中的溴应先选择装置___(填Ⅰ、Ⅱ或Ⅲ序号)。
Ⅱ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液备用。请回答下列问题:
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、___、胶头滴管。
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为___克。
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水___2次~3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度___处,改用胶头滴管加水,使溶液___。
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是____(填编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe及其化合物在日常生活中有很多应用,请按要求填空:
(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是_______。(填“还原性”或“氧化性”)
(2)Fe2+是一种非常好的还原剂,能够与很多氧化剂发生反应。在加热条件下,FeSO4可与硫酸酸化的KNO3反应,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NO气体。
①请写出该化学反应方程式,并用单线桥表示出电子转移的方向和数目______。
②上述反应发生还原反应的物质是___。
③若11.4gFeSO4参与反应,则产生NO气体的体积(标况下) ______L。
(3)难溶物FeS能够与硫酸酸化的KMnO4溶液反应,反应方程式如下:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+l0_____+24H2O
①横线上的物质的化学式是。
②该反应的氧化产物是___。
③若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生转移的电子数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:

已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着含氮元素不同物质间的转化,实现氮按照一定的方向转化一直是科学领域研究的重要课题。氮气在催化剂作用下的一系列转化如图所示:
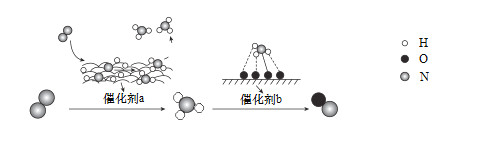
下列叙述正确的是
A.N2转化为NH3、NH3转化为NO均属于氮的固定
B.在催化剂a的作用下,氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.催化剂a、b均可以提高单位时间内反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾别名青矾、皂荚矾等,是我国古代常用的药材,以硫铁矿[主要成分为二硫化亚铁(FeS2)]为原料制备绿矾晶体,工艺流程如下:
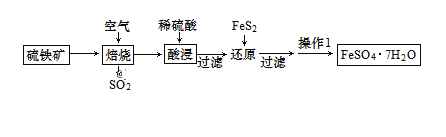
下列说法正确的是
A.焙烧过程中每生成1molSO2转移电子数为5.5NA
B.还原后所得滤液可用高锰酸钾检验Fe3+是否反应完全
C.为中和还原后滤液中过量的酸,可加入一定量FeCO3
D.操作1为蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、M的原子序数依次增大。元素X和铝在元素周期表中具有特殊的“对角线”关系,单质及化合物的性质十分相似;Y原子半径在短周期主族元素中最大;Z元素有多种同素异形体,其中一种为正四面体结构,易自燃;M基态原子未成对电子数在同周期元素中最多。
请回答下列问题:
(1)元素Z在周期表中的位置是_______。
(2)元素X的氧化物能与Y的氧化物的水化物形成的溶液反应,生成一种四配位化合物,写出该化合物的化学式________。
(3)元素Y的氢化物被称作“万能还原剂”,具有强的还原性。其电子式为______,遇水可发生反应的化学方程式为________。
(4)元素M的名称为_______,其+3价氧化物与铝反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)基态硒原子的价电子排布式为________;硒所在主族元素的简单氢化物中沸点最低的是________。
(2)电还原法制备甲醇的原理为2CO2+4H2O![]() 2CH3OH+3O2。
2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式________;
②标准状况下,V L CO2气体含有________个π键。
(3)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π![]() 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为
右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为![]() ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
(4)黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为________;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是________g·cm-3(不必计算或化简,列出计算式即可)。
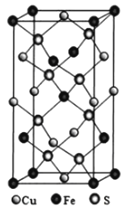
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题。
(1) 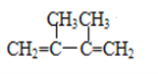 (命名)_____________________________________。
(命名)_____________________________________。
(2) 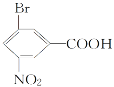 (指出所含官能团名称)_____________________________________。
(指出所含官能团名称)_____________________________________。
(3)写出以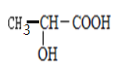 为单体发生缩聚反应的方程式________________________。
为单体发生缩聚反应的方程式________________________。
(4) 制TNT炸药的反应________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com