
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:

已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
【答案】催化氧化 羰基 乙二醇 CH2=CHCH3 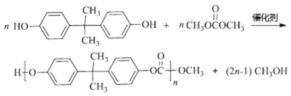 21
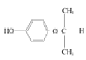
21 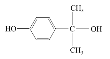 、
、
【解析】
A为CH2=CH2,A发生氧化反应生成环氧乙烷,反应③为信息i的反应,生成HOCH2CH2OH和CH3OCOOCH3;④是加成反应,根据原子守恒知,G为C3H6,G的核磁共振氢谱有三种峰,则G为CH2=CHCH3,根据K结构简式知,J为![]() ;J发生氧化反应生成丙酮和L,根据L分子式及M结构简式知,L为
;J发生氧化反应生成丙酮和L,根据L分子式及M结构简式知,L为![]() ,F、M发生信息i的反应生成N,则F为CH3OCOOCH3,E为HOCH2CH2OH,
,F、M发生信息i的反应生成N,则F为CH3OCOOCH3,E为HOCH2CH2OH,
(1)根据分析可知,A为CH2=CH2,A发生氧化反应生成环氧乙烷,①的反应类型是催化氧化;根据K的结构简式,K中含有的官能团名称是羰基,
答案为:催化氧化;羰基;
(2)根据分析可知,E为HOCH2CH2OH,E的名称是乙二醇,
答案为:乙二醇;
(3)根据分析可得,④是加成反应,根据原子守恒知,G为C3H6,G的核磁共振氢谱有三种峰,则G为CH2=CHCH3,
答案为:CH2=CHCH3;
(4)F为CH3OCOOCH3,F、M发生信息i的反应生成N,⑦的化学方程式是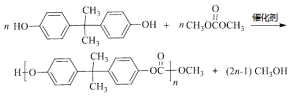 ,
,
故答案为: ;
;
-OOCH2CH3 -CH3
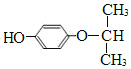
(5)分子式为C9H12O2且a.属于芳香化合物 ,且苯环上只有两个取代基,b.1mol该物质能消耗1molNaOH,即苯环上只有一个酚羟基,则该有机物的苯环上可以连一个羟基和一个![]() 或-CH2CH2CH2OH或
或-CH2CH2CH2OH或![]() 或
或![]() 或
或![]() ,分别处于邻间对位置,共5×3=15种,还可以为苯环上连一个羟基和一个
,分别处于邻间对位置,共5×3=15种,还可以为苯环上连一个羟基和一个 或-O-CH2-CH2-CH3,分别处于邻间对位置,则共有3×2=6种同分异构体;则符合要求的同分异构体的数目为21种;核磁共振氢谱有5组峰,说明该物质含有5种不同环境的氢原子,物质的结构简式
或-O-CH2-CH2-CH3,分别处于邻间对位置,则共有3×2=6种同分异构体;则符合要求的同分异构体的数目为21种;核磁共振氢谱有5组峰,说明该物质含有5种不同环境的氢原子,物质的结构简式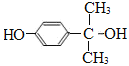 ,
, ,答案为:21;
,答案为:21; 、
、 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是

A. 常温下NiCO3的溶解度大于NiS的溶解度
B. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C. 对于曲线I,在b点加热,b点向c点移动
D. P为3.5且对应的阴离子是CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.物质的量浓度为0.5 mol/L的MgCl2溶液中含有NA个Cl-
C.标准状况下,11.2 L H2O含有的分子数为0.5 NA
D.在常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH4+)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:①微生物脱氮法:NH4+ ![]() NO3-
NO3- ![]() N2;②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
N2;②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4·6H2O沉淀从而去除氨氮,下列有关说法正确的是
A. 该废水大量直接排放,对水体的影响不大
B. 微生物脱氮时可在高温下进行,以加快脱氮的速率
C. 步骤a发生反应:NH4++2O2=NO3-+H2O+2H+
D. 化学沉淀法脱氮时,溶液的碱性越强,氨氮的去除率将升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
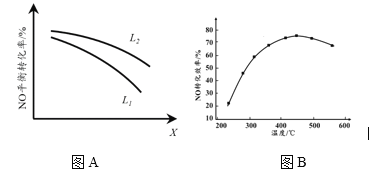
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
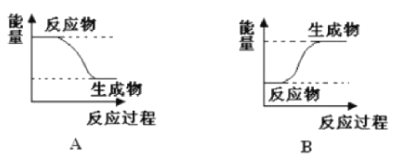
I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_____(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
2C(g),若经2s后测得C的浓度为0.6mol·L-1,则
(1)用物质A表示的反应速率为____。
(2)用物质B表示的反应速率为____。
(3)2s时物质B的转化率为_____。
(4)2s时物质A的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。实验室制备少量NaClO2的装置如图所示。装置I控制温度在35~55°C,通入SO2将NaClO3还原为ClO2(沸点:11°C)。

回答下列问题:
(1)装置Ⅰ中反应的离子方程式为__________________。
(2)装置Ⅱ中反应的化学方程式为_____________________。
(3)装置用中NaOH溶液的作用是_____________。
(4)用制得的NaClO4/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)和溶液pH对脱硫、脱硝的影响如图所示:

①从图1和图2中可知脱硫、脱硝的最佳条件是n(H2O2)/n(NaClO2)=________________。pH在_________________之间。
②图2中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小。NO去除率减小的可能原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
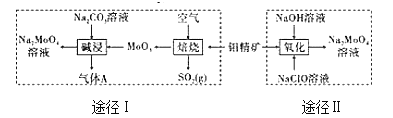
(1)途径Ⅰ还原剂与氧化剂物质的量之比为(不考虑杂质的反应)_____;碱浸时气体A的电子式为_______。
(2)途径II氧化时溶液中还有Na2SO4生成,则反应的离子方程式为____。
(3)已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.40mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当CO32-的除去率为90%时,列式计算此时是否有BaMoO4沉淀生成____。[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(4)途径II所得的BaMoO4溶液结晶后再经过重结晶可使钼酸钠晶体的纯度提高,其利用的原理是_____。
(5)某锂电池放电过程中,电极上发生Lix(MoS2)n与MoS2之间的转化。则电池放电时正极的电极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com