
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
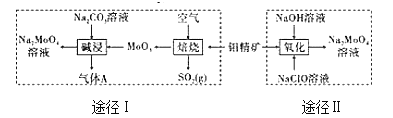
(1)途径Ⅰ还原剂与氧化剂物质的量之比为(不考虑杂质的反应)_____;碱浸时气体A的电子式为_______。
(2)途径II氧化时溶液中还有Na2SO4生成,则反应的离子方程式为____。
(3)已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.40mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当CO32-的除去率为90%时,列式计算此时是否有BaMoO4沉淀生成____。[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(4)途径II所得的BaMoO4溶液结晶后再经过重结晶可使钼酸钠晶体的纯度提高,其利用的原理是_____。
(5)某锂电池放电过程中,电极上发生Lix(MoS2)n与MoS2之间的转化。则电池放电时正极的电极反应式为_____。
【答案】2:7 ![]() MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O CO32-的去除率为90%时,c(CO32-)=0.04mol/L,c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不会生成BaMoO4沉淀 Na2MoO4与杂质的溶解度受温度的影响不同 nMoS2+xLi++xe-=Lix(MoS2)n
MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O CO32-的去除率为90%时,c(CO32-)=0.04mol/L,c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不会生成BaMoO4沉淀 Na2MoO4与杂质的溶解度受温度的影响不同 nMoS2+xLi++xe-=Lix(MoS2)n
【解析】
(1)途径I MoS2与氧气反应生成MoO3和二氧化硫,Mo化合价由+2到+6升4,S化合价由-1到+4升5,1mol MoS2反应转移电子14mol,而氧气中氧元素由0价变为-2价,根据电子得失守恒可知还原剂MoS2与氧化剂O2物质的量之比为2:7;途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;碱浸时气体A(CO2)的电子式为![]() ;
;
(2)途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,离子反应方程式为MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)CO32-的去除率为90%时,溶液中c(CO32-)=0.04mol/L,则溶液中c(Ba2+)=2.5×10-8 mol/L,c(MoO42-)×c(Ba2+)=0.4×2.5×10-8=10-8<Ksp[BaMoO4],因此不会生成BaMoO4沉淀;
(4)途径II所得的BaMoO4溶液结晶后再经过重结晶可使钼酸钠晶体的纯度提高,其利用的原理是Na2MoO4与杂质的溶解度受温度的影响不同;
(5)某锂电池放电过程中,电极上发生Lix(MoS2)n与MoS2之间的转化。则电池放电时正极MoS2得电子产生Lix(MoS2)n,电极反应式为nMoS2+xLi++xe-=Lix(MoS2)n。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:

已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)基态硒原子的价电子排布式为________;硒所在主族元素的简单氢化物中沸点最低的是________。
(2)电还原法制备甲醇的原理为2CO2+4H2O![]() 2CH3OH+3O2。
2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式________;
②标准状况下,V L CO2气体含有________个π键。
(3)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π![]() 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为
右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为![]() ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
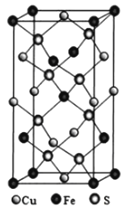
(4)黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为________;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是________g·cm-3(不必计算或化简,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体在标况下的密度为__________g/L。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于0.1L水中(水的密度:1g·mL-1,且不考虑反应),其溶液中溶质的质量分数为_____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的单质及X与元素Y形成的化合物存在如图所示的关系(其中m≠n,且均为正整数).下列说法正确的是( )
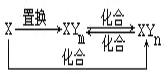
A. X一定是金属元素
B. (n-m)一定等于1
C. 由X生成1molXYm时转移的电子数目一定为4NA
D. 三个化合反应一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2) Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为________(各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
(5)化合物甲由X、Z、M、W和Fe五种元素组成,甲的摩尔质量为392g·mol-1, 1 mol甲中含有6 mol结晶水。对化合物甲进行如下实验:
a.取甲的水溶液少许,加入过量的浓NaOH溶液,加热,产生白色絮状沉淀和无色、有刺激性气味的气体;白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
b.另取甲的水溶液少许,加入过量的BaCl2溶液,产生白色沉淀;再加盐酸,白色沉淀不溶解。
① 甲的化学式为________。
② 已知100 mL 1 mol·L-1的甲溶液能与20 mL 1 mol·L-1的酸性KMnO4溶液恰好反应,写出反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题。
(1) 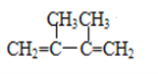 (命名)_____________________________________。
(命名)_____________________________________。
(2) 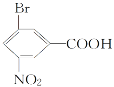 (指出所含官能团名称)_____________________________________。
(指出所含官能团名称)_____________________________________。
(3)写出以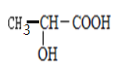 为单体发生缩聚反应的方程式________________________。
为单体发生缩聚反应的方程式________________________。
(4) 制TNT炸药的反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等)回收钴的工艺流程如下:
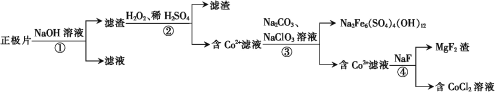
下列叙述错误的是
A.①中发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作还原剂
C.③中Na2CO3可用NaOH代替
D.④中除镁反应不宜在强酸条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率
分别如下,其中反应速率最大的是( )
A.v(C)=0.04 mol/(L·s)
B.v(B)=0.06 mol/(L·min)
C.v(A)=0.15 mol/(L·min)
D.v(D)=0.01 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com