
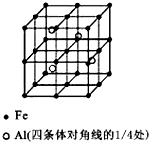
 一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:
一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 4 |
| ||
| a3 |
| 3 |
| ||
| 1 |
| 2 |
| 3 |
| ||
| 1 |
| 2 |
| 3 |
| ||


科目:高中化学 来源: 题型:
| A、①③⑥ | B、①⑥⑦⑧ |
| C、①②⑧ | D、①③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl HI H2 |
| B、H2S CO2 H2 |
| C、H2 SO2 HCl |
| D、NH3 N2 H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
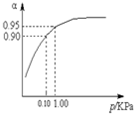 硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加聚反应也可能有水生成 |
| B、水是氧化物过氧化氢不是氧化物 |
| C、水可以参与有些有机反应,有些有机反应也有水生成 |
| D、水、乙醇、氢氧化钠中都存在羟基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com