

科目:高中化学 来源: 题型:
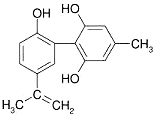 “人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )
“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )| A、该分子中的碳原子均为不饱和碳原子 |
| B、滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质分别与浓溴水和H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| D、遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
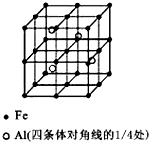 一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:
一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com