
����Ŀ������һ�ֺ��нᾧˮ���Σ���A��B��C��D��E����Ԫ����ɣ����������Ƕ�����Ԫ�ء�������ˮ��ɵ�������������Ӻ�һ�������ӣ�����A��B��Ԫ�ؿ��γ�10���ӵ������ӡ�AԪ��ԭ�Ӻ�����������E����1��D��E����ͬ���塣
�ü�������ʵ�飺
��ȡ�����ľ�����������ˮ�����Һ��
��ȡ��������Һ���Թ��е���KSCN��Һ���������ٵ�����������������Һ���ʺ�ɫ��
��ȡ��������Һ���Թ��У������м���ϡ������ټ���BaCl2��Һ�����ְ�ɫ������
��ȡ��������Һ���Թ��м�������NaOH��Һ�����ȣ�
�ش��������⣺
��1��ʵ������֤����Һ�к��� ��
��2�������ӷ���ʽ��ʾʵ�����������ԭ�� �� ��
��3��ʵ�����г��ֵ������� ��
��4�����ⶨ�����Ħ������Ϊ392 g/mol�����������������������ʵ���֮��Ϊ3:2�������Ļ�ѧʽΪ ��
���𰸡���1��SO42������2��H2O2+2Fe2++2H+==2H2O+2Fe3+��Fe3++3SCN-![]() Fe(SCN)3����3���а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4��(NH4)2Fe(SO4)2��6H2O [��Fe(NH4)2(SO4)2��6H2O]��
Fe(SCN)3����3���а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4��(NH4)2Fe(SO4)2��6H2O [��Fe(NH4)2(SO4)2��6H2O]��
�����������������������KSCN��Һ��Һ���Ժ�ɫ������������⣬��Һ�Ժ�ɫ��˵��ԭ��Һ�к���Fe2�������������ᣬ�ټ���BaCl2��Һ�����ְ�ɫ������˵��ԭ��Һ�к���SO42�������������ƶϣ�D��EΪO��S��A��B����10���ӵ������ӣ���A����������E��1�����ӣ��Ƴ�AΪN��EΪO��DΪS��BΪH��A��B�γ�10���ӵ�������ΪNH4������1����������������ʵ����֤��ԭ��Һ�к���SO42����(2)���ù��������ǿ�����ԣ���Fe2��������Fe3���������ӷ�Ӧ����ʽΪH2O2+2Fe2++2H+==2H2O+2Fe3+��Fe3����SCN��������Ϸ�Ӧ��Fe3++3SCN-![]() Fe(SCN)3����3��ʵ�����м���NaOH��Һ���ȷ���Fe2����2OH��=Fe(OH)2�������ְ�ɫ��״������4Fe(OH)2��O2��2H2O=4Fe(OH)3�������ֺ��ɫ�����������μ��������ƣ�OH����NH4��
Fe(SCN)3����3��ʵ�����м���NaOH��Һ���ȷ���Fe2����2OH��=Fe(OH)2�������ְ�ɫ��״������4Fe(OH)2��O2��2H2O=4Fe(OH)3�������ֺ��ɫ�����������μ��������ƣ�OH����NH4��![]() NH3����H2O���д̼�����ζ����������а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4�����ݻ��ϼ۵Ĵ�����Ϊ0��ȷ�ϲ����ᾧˮ�Ļ�ѧʽΪ(NH4)2Fe(SO4)2������Ħ������Ϊ392g��mol��1�����1mol�ᾧˮ�����к���6mol�ᾧˮ������ѧʽΪ��(NH4)2Fe(SO4)2��6H2O��
NH3����H2O���д̼�����ζ����������а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ�������д����̼�����ζ�������ɣ�������ʹʪ��ĺ�ɫʯ����ֽ�������������ɣ�����4�����ݻ��ϼ۵Ĵ�����Ϊ0��ȷ�ϲ����ᾧˮ�Ļ�ѧʽΪ(NH4)2Fe(SO4)2������Ħ������Ϊ392g��mol��1�����1mol�ᾧˮ�����к���6mol�ᾧˮ������ѧʽΪ��(NH4)2Fe(SO4)2��6H2O��


 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ���⡿�����й�˵������ȷ����( )
A����ѧʵ�����е����Ǵ��Ⱥܸߣ�Ҳ��������ʳ��
B��ʵ��������ȡ���ж����壬����ͨ�缴��
C��ʵ�������ù��ķ�ϴҺ������������ϴ����
D���������ֽӴ�ҩƷ����Ҫ�ѱǿ״յ�������ȥ��ҩƷ����ζ�����ó��κ�ҩƷ��ζ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ��ͨ������SiO2��26Al��10Be����Ԫ�صı�����ȷ���������������䣬���ֲ���������������귨������26Al��10Be��˵������ȷ���ǣ� ��
A. 10Be��9Be����������ͬ��������ͬ�IJ�ͬԭ��
B. 10Be��ԭ�Ӻ�������������������2222
C. 2.6g26Al3+�������ĵ�����ԼΪ6.02��1023
D. 26Al3+��26Mg2+�����������������͵�����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���ʽṹ������]
���仯�����ڹ�ҵ����������;����ҵ���������Ϊԭ���Ʊ����ᣬ�������Mg��Fe��Ca��Al��B��O�ȶ���Ԫ�أ�������Ҫ�ɷ�ΪMg2B2O5��H2O��Fe3O4��
��1����̬��ԭ�ӵ���Χ���Ӳ��Ų�Ϊ ����Ԫ��λ��Ԫ�����ڱ��еĵ� �壬��ˮ��Һ�г���Fe2+��Fe3+����ʽ���ڣ����� ���ȶ���
��2��������Ϊԭ�Ͽ��Ƶ�NaBH4, Bԭ�ӵ��ӻ���ʽΪ ��
��3����ҵ��ұ���������Ȼ�������Ϊ�Ȼ�������������˫����Al2Cl6�ṹ��ͼ��ʾ��1mol�÷����к� ����λ�����÷��� ����������������������ƽ���ͷ��ӡ�

��4�����ݵڶ�����Ԫ�ص�һ�����ܵı仯���ɣ�����ͼ��B��C��O��FԪ�ص�λ�ã���С�ڵ��ʾNԪ�ص����λ�á�

��5��Al����Ϊ�����������壬�侧�����a=0.405nm����ʽ��ʾAl���ʵ��ܶȣ� g��cm��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���������ʵ�鷽������Ũ������ͭƬ��Ӧ�Ʊ�SO2����������ʵ��̽����ʵ��װ������ͼ��ʾ��
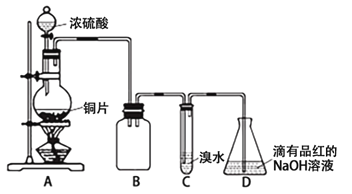
��ش��������⣺
��1��װ��B�������� ��
��2�����װ��C��Ŀ������֤SO2�� �ԣ�װ��C�з�����Ӧ�����ӷ���ʽ�� ��װ��D��NaOHȫ��ת��ΪNaHSO3�ı�־�� ��
��3����NaHSO3��Һ�м���NaClO��Һʱ����Ӧ�����ֿ��ܵ������
I��HSO3����ClO��ǡ�÷�Ӧ
����NaClO����
����NaClO����
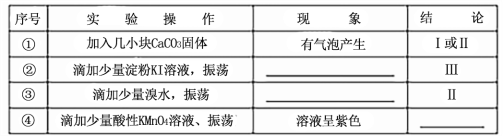
��ͬѧ�ֱ�ȡ���������Һ���Թ��У�ͨ������ʵ��ȷ���÷�Ӧ������һ�������������±�������֪���ԣ�H2SO3>H2CO3>HClO��
��4������Ƽ�ʵ��֤����������HSO3-�ĵ���ƽ�ⳣ��Ka��ˮ��ƽ�ⳣ��Kb����Դ�С�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ������ˮ��ȡ��������ˮ�ļ���װ�ã������ȼ��̶������ԣ�����ԭ����̲��е�ʵ����ȫ��ͬ���ش��������⣺
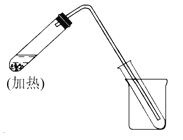
����ߴ��Թ���Ҫ���뼸Ƭ���Ƭ���������� ��
����װ����ʹ�õIJ������ܽϳ����������� ��
���ձ��л�Ҫʢ�е������� ��
��2������ͼ��ʾa��b��c��d�ֱ��Ǽ��ֳ���©�����ϲ���A��B��C��D��ʵ�ʲ����и�©�����²����������е�ʾ��ͼ����ָ��A��B��C��D�ֱ���a��b��c��d��ƥ�����ϼ�����Ϻ�װ����ʵ���е�Ӧ�ã����磺C��a��ϣ�������ȡ���塣

��A�� ��ϣ����� ����B�� ��ϣ����� ��
��B�� ��ϣ����� ����D�� ��ϣ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵���У��������
A��������������Ư�� B��Һ�������������
C������̿����ȥ�������е���ζ D��������������뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ�����MnSO4��ZnSO4��ȡZn��MnO2��ԭ��Ϊ���̿����п�����̿��к�MnO2Լa%��SiO2Լ20%��Al2O3Լ4%������Ϊˮ�֣���п���к�ZnSԼ80%��FeS��CuS��SiO2��Լ7%������Ϊˮ����
I����1��Ϊ�˲������̿���MnO2�����IJⶨ���ֽ�14��5g���̿�����������ϡ�����У����������ĵ⻯�ؾ��壬��ַ�Ӧ���ˣ�����Һ��ˮϡ����1L��ȡ25��00ml����Һ����ƿ�У����뼸�ε�����Һ��ָʾ������0��1000molL��1�ı�Na2S2O3��Һ�ζ������ı�Һ50��00ml�������̿���MnO2���� ������֪��2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4�� I2+2S2O32��=2I��+S4O62����
��������Ա�������ۺ�������������Դ��ͬ��������գ�����������ͼ1��ʾ��

��ش��������⣺
��2����ӦI����Һ�к���MnSO4��ZnSO4��CuSO4��Fe2��SO4��3��Al2��SO4��3��������ɷ�ӦI������CuSO4��MnSO4�Ļ�ѧ����MnO2+CuS+ = + +CuSO4+MnSO4��
��3����Ӧ���������п�������� �����п�����������һ��������Ӧ�����ӷ���ʽΪ ��
��4��ͼ2��Na2SO4��Na2SO410H2O���ܽ��������g/100gˮ��������еõ�Na2SO4����IJ����ǣ��������MnCO3��ZnCO3�����Һ���½ᾧ�� �����Ҵ�ϴ�ӡ����������Ҵ�ϴ�Ӷ�����ˮϴ��ԭ���� ��

��5���ö��Ե缫���MnSO4��ZnSO4�Ƶ�Zn��MnO2���ܷ�Ӧ�ǣ� ��
��6�������տ���ѭ�����õ����ʳ�MnO2��MnCO3��ZnCO3���⣬���� ��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҵ�������ɵĻ�������У���̼Ԫ�ص������ٷֺ���Ϊ60%������Ԫ�ص������ٷֺ���Ϊ(���� )
A. 15% B. 21% C. 25% D. ��ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com