
【题目】(1)下图是自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
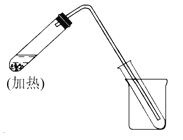
①左边大试管中要加入几片碎瓷片,其作用是 。
②该装置中使用的玻璃导管较长,其作用是 。
③烧杯中还要盛有的物质是 。
(2)如下图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。

①A与 组合,用于 ,②B与 组合,用于 ,
③B与 组合,用于 ,④D与 组合,用于 。
【答案】(1)①防止暴沸; ②导气兼冷凝; ③冰(冷)水;
(2)①c 制取气体;②b分液;③d 过滤;④d 添加酒精
【解析】
试题分析:①液态混合物加热,为了防止液面剧烈跳动,要加入碎瓷片,因此左边大试管中要加入几片碎瓷片,其作用是防止暴沸;②该装置中使用的玻璃导管较长,一方面是使产生的水蒸气通过导管进入到右侧的试管中,另一方面是利用空气的温度低于水蒸气的温度,使其充分冷凝转化为液体水,故导气管的作用是导气兼冷凝的作用;③为了使水蒸气快速冷凝降温,在盛有接水蒸气的试管中要加入冷却水或冰水予以降温;(2)①A与c 组合可用于用H2O2和MnO2混合制取O2气体;②B与b组成分液漏斗,可进行分液操作;③B与d组合形成普通的过滤装置,进行过滤操作;④D与d组合,可组成向酒精灯中添加酒精的操作。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸或者SiO2不是H2SiO3的酸酐
B.CO2通入水玻璃,可以得到硅酸沉淀
C.SiO2是一种空间立体网状结构的晶体,熔点高,硬度大
D.氢氟酸能够腐蚀玻璃,故不能用玻璃瓶来装氢氟酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的分离方法不正确的是( )
A. 用过滤的方法除去食盐水中的泥沙
B. 用蒸馏的方法将自来水制成蒸馏水
C. 用酒精萃取碘水中的碘
D. 用分液的方法除去四氯化碳中的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.检验Cl-的试剂是硝酸银和硝酸
B.检验SO42-的试剂是氯化钡和盐酸
C.检验CO32-的试剂是盐酸、澄清石灰水和氯化钙
D.向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种含有结晶水的盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出两种阳离子和一种阴离子,其中A、B两元素可形成10电子的阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。
用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入过氧化氢的酸性溶液,呈红色;
③取少量甲溶液于试管中,向其中加入稀盐酸后,再加入BaCl2溶液,出现白色沉淀;
④取少量甲溶液于试管中加入适量NaOH溶液,加热;
回答下列问题:
(1)实验③可证明溶液中含有 。
(2)用离子方程式表示实验②中现象的原因: , 。
(3)实验④中出现的现象是 。
(4)经测定甲晶体的摩尔质量为392 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义。
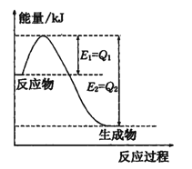
(1)如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式____________(△H的数值用含字母Q1、Q2的代数式表示):
(2)已知:25℃时KSP(AgCl)=1.6×l0-10KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是 ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(3)氨气溶于水得到氨水。在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后体积为混合前体积之和),反应后溶液显中性。求25℃下该混合溶液中氨水的电离平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钠、氢氧化钠 B.氧化铜、二氧化锰
C.氯化钾、二氧化锰 D.硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3A+B═2C,下列说法正确的是()
A. 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的
B. 其他条件不变,增大压强,反应速率加快
C. 若增加或减小B的物质的量,则反应速率一定会发生明显的变化
D. 其他条件不变,升高温度,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为 。
(2)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH![]() 氧化为
氧化为
NO![]() (2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO
(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO![]() 反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
(3)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s)![]() 5CO2(g) +I2(s)。不
5CO2(g) +I2(s)。不
同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间
t变化曲线如图所示。则:

①T2温度时,0~0.5 min的反应速率v(CO)= 。
②T1温度时,反应达到平衡,CO的转化率为 ,化学平衡常数K= (用具体数值表示)。
③下列说法正确的是 (填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
(4)将500 mL(标准状况)甲醇不完全燃烧产生的气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100 mL。取25.00 mL,用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com