
【题目】甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为 。
(2)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH![]() 氧化为
氧化为
NO![]() (2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO
(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO![]() 反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
(3)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s)![]() 5CO2(g) +I2(s)。不
5CO2(g) +I2(s)。不
同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间
t变化曲线如图所示。则:

①T2温度时,0~0.5 min的反应速率v(CO)= 。
②T1温度时,反应达到平衡,CO的转化率为 ,化学平衡常数K= (用具体数值表示)。
③下列说法正确的是 (填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
(4)将500 mL(标准状况)甲醇不完全燃烧产生的气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100 mL。取25.00 mL,用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
【答案】(1)726.5 kJ·mol-1;
(2)6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
(3)①0.8 mol·L-1·min-1;②80%,1024;③BC;(4)8.96%。
【解析】
试题分析:(1)甲醇燃烧的反应:
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l),
CO(g)+2H2(g) ![]() CH3OH(g) ,
CH3OH(g) ,
2H2(g)+O2(g)=2H2O(l),
2CO(g)+O2(g)=2CO2(g),
CH3OH(g)=CH3OH(l) ,
②-①+③/2-④,得出:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5 kJ·mol-1;(2)甲醇和NO3-反应转化成两种无毒气体,无毒气体为N2和CO2,CH3OH中C显-2,由-2价→+4价,NO3-中N有+5价→0价,利用化合价的升降法进行配平,其离子反应方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;(3)①反应前后气体系数之和相等,CO2的反应速率是v(CO2)=2×0.4/(2×0.5)mol/(L·min)=0.8 mol/(L·min),根据化学反应速率之比等于化学计量数之比,即v(CO)=0.8mol/(L·min);②CO的转化率为2×0.8/2×100%=80%;故错误;(4)达到平衡时,c(CO2)=2×0.8/2mol·L-1,c(CO)=(2-0.8×2)/2mol·L-1=0.2mol·L-1,K=c5(CO2)/c5(CO)=(0.8/0.2)5=1024;③A、反应前后气体系数之和相等,因此压强不变,不能达到平衡,故错误;B、根据密度的定义,气体质量增加,但容器的体积不变,因此密度不变,说明反应达到平衡,故正确;C、CO和CO2的气体系数之和相等,消耗CO2多,说明反应向逆反应方向进行,即v正小于v逆,故正确;D、根据图像T2的温度比T1的温度高,因此T2中气体压强大于T1,故错误;E、T2的温度高于T1的温度,随着温度的升高CO2的体积分数降低,说明正反应方向是放热反应,原溶液中生成n(I2)=20×10-3×0.01×100/(2×25)mol=4×10-4mol,生成n(CO)=5×4×10-4mol=2×10-3mol,CO的体积分数为2×10-3×22.4/500×10-3×100%=8.96%。


科目:高中化学 来源: 题型:
【题目】(1)下图是自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
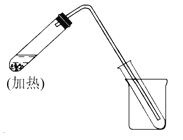
①左边大试管中要加入几片碎瓷片,其作用是 。
②该装置中使用的玻璃导管较长,其作用是 。
③烧杯中还要盛有的物质是 。
(2)如下图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。

①A与 组合,用于 ,②B与 组合,用于 ,
③B与 组合,用于 ,④D与 组合,用于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入H2S,HS—浓度增大
C.升高温度,c(HS—)/c(S2—)减小
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烷和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
A. 15% B. 21% C. 25% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象、解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇具有氧化性 |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
D | 用硫酸做催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉未发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超氧化钾(KO2)又称为化学氧自救剂,容易与空气中的水、二氧化碳等发生反应,主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去).

请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为 (填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:① ;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物.
(3)数据记录如下:
空陶瓷管的质量 | 陶瓷管与钾的总质量 | 陶瓷管与产物的总质量 |
14.80g | 15.19g | 15.47g |
根据数据计算可得实验式KOx,则x= 。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式: 。与过氧化钠相比,其优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.2mol分别放入100 mL 5 mol/L的盐酸中,同温同压下产生的气体体积比是
A. 2︰4︰5 B. 6︰3︰2 C. 3︰1︰l D. 1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘微溶于水,易溶于四氯化碳和酒精且碘易升华。现要将碘水中的碘分离出来,下列说法合理的是( )
A.碘易升华,可采用加热的方法将碘从溶液中升华出来
B.碘易溶于四氯化碳和酒精,所以可选用两种试剂中的任意一种进行萃取
C.四氯化碳比水重,酒精比水轻,所以用四氯化碳进行萃取比用酒精好
D.四氯化碳不溶于水,酒精溶于水,所以用四氯化碳萃取,不能用酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com