
【题目】下列分散系属于悬浊液的是( )
A.硅酸溶胶B.蔗糖溶液C.泥浆水D.氢氧化铁胶体
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中常见的物质,说法正确的是( )
A. 苯分子中的化学键是单双键交替结构 B. 聚乙烯能和溴水发生加成反应
C. 所有的糖类都能水解 D. 75%的酒精可以用于医疗杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
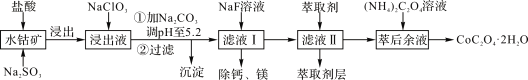
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:_________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H+C2O42- Ka2=5.4×10-5
H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 盐酸与
盐酸与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是____________________。能否改用铜丝_______(填“能、否”),原因是____________________________
(2)大烧杯上如不盖硬纸板,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(3)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替![]() 溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(5)取![]() 溶液和
溶液和![]() 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________________ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
则中和热![]() __________(取小数点后一位。)(本题中
__________(取小数点后一位。)(本题中![]() 溶液和硫酸溶液的密度均取
溶液和硫酸溶液的密度均取![]() ,中和后生成溶液的比热容取
,中和后生成溶液的比热容取![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第______,周期___族。Se2Cl2常用作分析试剂,其电子式为_______。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HC1O与Cu2Se的物质的量之比为____。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家在青蒿素应用领城取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯。下列有关说法正确的是
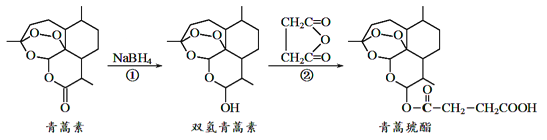
A. 青蒿素分子中所有碳原子在同一平面内
B. 反应①属于还原反应,反应②理论上原子利用率可达100%
C. 双氢青蒿素属于芳香族化合物
D. 青蒿琥酯可以发生水解、酯化以及加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了做吸水剂和脱水剂的作用外还有_________;
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__(选填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是_________;
[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mI乙醇,2m1冰醋酸,并在摇动下缓缓加入2mI浓硫酸充分摇匀,(2)将试管固定在铁架上;(3)在试管②中加入适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。

[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、____;
b.试管②中饱和Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有______的作用;
c.从试管②中分离出乙酸乙酯的实验操作是______;
d、生成乙酸乙酯的化学反应方程______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com