
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式,再利用氧化还原反应中电子转移计算,然后计算标准状况下气体的体积;
(2)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;平衡常数K=$\frac{c(S{O}_{3})c(NO)}{c(N{O}_{2})c(S{O}_{2})}$;
(3)利用化学平衡的影响因素和工业生产的关系来分析,由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高.
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移12mol电子时,消耗的NO2为12÷4×22.4L=67.2L,
故答案为:3NO2+H2O═2HNO3+NO;67.2;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1,利用盖斯定律将①×$\frac{1}{2}$-②×$\frac{1}{2}$得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=$\frac{1}{2}$×(-196.6kJ•mol-1)-$\frac{1}{2}$×(-113.0kJ•mol-1)=-41.8kJ•mol-1,
A.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误;
B.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故B正确;
C.SO2和NO的体积比保持不变,说明一氧化氮消耗和二氧化硫消耗相同,在化学方程式定量关系可知,证明反应正逆反应速率相同,能判断是否达到平衡状态,故C正确;
D.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,反应逆向进行不能判断是否达到平衡状态,故D错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即$\frac{a-x}{2a-x}$=1;6,故x=$\frac{4}{5}$a,
故平衡常数K=$\frac{c(S{O}_{3})c(NO)}{c(N{O}_{2})c(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{(\frac{4}{5}a)^{2}}{(a-\frac{4}{5}a)(2a-\frac{4}{5}a)}$=$\frac{8}{3}$,
故答案为:-41.8,BC; $\frac{8}{3}$;
(3)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强.
故答案为:<,在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、平衡常数、盖斯定律以计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
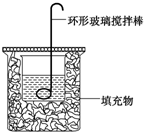 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3 | B. | Cu→CuSO4 | C. | Fe→FeCl2 | D. | Al→Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 +NaOH→
+NaOH→ +
+
 +HCl→
+HCl→

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
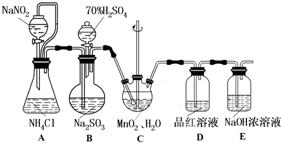
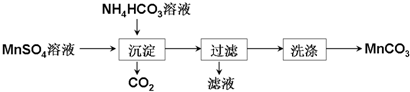
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com