
| A. | 19gNHD2和19gNH2T中含有的中子数均为9NA | |
| B. | 1molCnH2n+2中含有的共用电子对数为(3n+1)NA | |
| C. | 2 mol Na2O2有的阴离子数为4NA | |
| D. | 2 mol SO2和1 molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
分析 A.19gNHD2物质的量=$\frac{19g}{19g/mol}$=1mol,19gNH2T物质的量=$\frac{19g}{19g/mol}$=1mol,中子数=质量数-质子数计算;
B.分子式为CnH2n+2分子中含有n-1个C-C键,2n+2个C-H键;
C.过氧化钠是钠离子和过氧根离子构成;
D.二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底.
解答 解:A.中子数=质量数-质子数计算,NHD2和19NH2T中,19gNHD2物质的量=$\frac{19g}{19g/mol}$=1mol,中子数=14-7+1-1+(2-1)×2=9,19gNH2T物质的量=$\frac{19g}{19g/mol}$=1mol,中子数=14-7+(1-1)×2+3-1=9,19gNHD2和19gNH2T中含有的中子数均为9NA,故A正确;
B.分子式为CnH2n+2分子中含有n-1个C-C键,2n+2个C-H键,1molCnH2n+2中含有的共用电子对数为(3n+1)NA,故B正确;
C.过氧化钠是钠离子和过氧根离子构成,2 mol Na2O2有的阴离子数为2NA,故C错误;
D.二氧化硫和氧气反应生成三氧化硫是可逆反应不能进行彻底,1mol O2和2mol SO2在一定条件下,充分反应生成SO3的分子数小于2NA ,所得混合气体的分子数大于2NA ,故D正确;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用、可逆反应分析、氧化还原反应的转移计算应用、分子结构,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小比较:r(N3-)>r(O2-) | |
| B. | N元素与氧元素形成的化合物只有五种 | |
| C. | 在该反应条件下,NH3的还原性弱于的H2O还原性 | |
| D. | 在该反应中,反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加快反应速率 | |
| B. | 增大O2的浓度可使SO3的浓度减小 | |
| C. | 降低温度可以减小反应速率 | |
| D. | 增大SO2的浓度可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
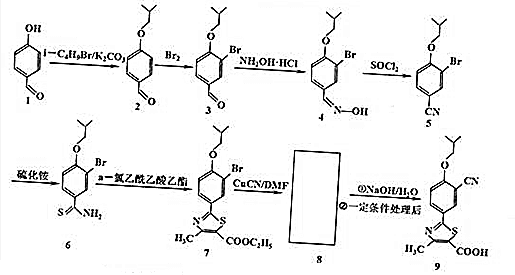
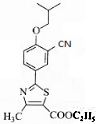 .
.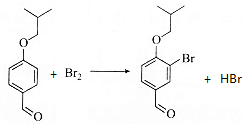 .
. .
.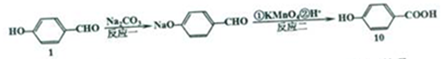
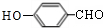 +Na2CO3→
+Na2CO3→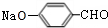 +NaHCO3,其目的是保护酚羟基,防止为氧化.
+NaHCO3,其目的是保护酚羟基,防止为氧化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ①④⑤⑥⑦ | D. | ①②⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 分子式 | C4H10O | C3H8 | C7H16 | C8H10 |
| 限定条件 | 能与钠反应 | 二氯代物 | 分子中含有3个甲基 | 芳香烃,能得到3中硝化产物 |
| 同分异构体数目 | 4 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷只有一种,说明甲烷分子是立体结构 | |
| B. | 2-丁烯四个碳原子共平面,说明乙烯分子是平面结构 | |
| C. | 苯乙炔分子中所有原子共平面,说明乙炔分子中原子在一条直线上 | |
| D. | 邻二甲苯只有一种,说明苯分子中不存在单双键交替的碳碳键. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com