
【题目】NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 1mol苯乙烯(![]() )中含有的C=C数为NA
)中含有的C=C数为NA
B. 在标准状况下,11.2L四氯化碳含有分子数为0.5NA
C. 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
D. 1mol甲基含9NA个电子
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是 ( )
A. FeO溶于稀硝酸:FeO+2H+ ![]() Fe2++H2O
Fe2++H2O
B. Al2(SO4)3溶液中加入过量Ba(OH)2溶液:Al3++4OH- ![]() AlO2-+2H2O
AlO2-+2H2O
C. 漂白粉溶液中通入少量CO2: 2ClO-+H2O+CO2![]() 2HClO+CO32-
2HClO+CO32-
D. 向NaOH溶液中滴加过量Ca(HCO3)2溶液:Ca2++HCO3-+OH-![]() CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4(其中C为-4价)既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0gCH4完全燃烧生成二氧化碳和液态水时放出444.8kJ热量。若一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,则需要标准状况下的氧气约___L。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,通入2.24L(已换算为标准状况)a气体时,通过质子交换膜转移的H+数目为___(设NA为阿伏加德罗常数的值)。

(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在___℃左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其反应的离子方程式为___。
③CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2、CO2和H2O,若标准状况下8.96LCH4可处理22.4LNOx,则x值为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芬太尼类似物L具有镇痛作用。它的合成方法如下:

已知:
I、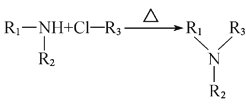 +HCl
+HCl
II、![]()
![]()
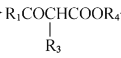 +R2OH;
+R2OH;
III、 (
(![]() 为氢或烃基)
为氢或烃基)
回答下列问题:
(1)A是一种烯烃,化学名称为______,其分子中最多有__________个原子共面。
(2) B中官能团的名称为_____、_____。②的反应类型为________
(3)③的化学方程式为________
(4)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。指出F的结构简式中手性碳原子并用星号(*)标出F中的手性碳________。G的结构简式为________。
(5)已知④有一定的反应限度,反应进行时加入吡啶(一种有机碱),其作用是________。
(6)参照上述合成路线,写出以环已烯(![]() )和乙醇为起始原料经三步制备化合物
)和乙醇为起始原料经三步制备化合物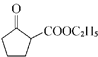 的合成路线________。
的合成路线________。
(已知:![]() 其他试剂任选)
其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)有下列各组物质:
(A) 和
和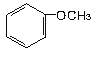 ;(B)CH2=CH-CH=CH2和CH3-CH2-C=CH;(C)
;(B)CH2=CH-CH=CH2和CH3-CH2-C=CH;(C) ;(D)
;(D)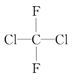 和
和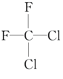 ;(E)甲烷和新戊烷
;(E)甲烷和新戊烷
其中____组两物质互为同系物;_______组两物质互为同分异构体;______组两物质互为同一物质;A组第一个物质的名称是:_________。
(2)写出1,3﹣丁二烯与Br2的CCl4溶液发生1,4﹣加成后的产物的结构简式:___________。
(3)写出由甲苯生成TNT(2,4,6﹣三硝基甲苯)的方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据甲烷燃烧的反应原理,设计如图a所示的电池装置:
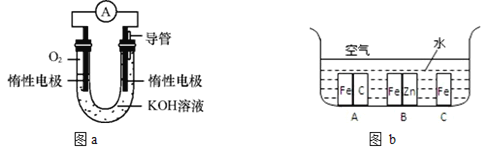
(1)该电池的能量转化形式为____________。
(2)该电池正极的电极反应为____________。
(3)工作一段时间后,测得溶液的pH______,该电池总反应的化学方程式为_________。
(4)在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重大问题。兴趣小组的同学在实验室对金属腐蚀进行了探究。如图b所示,铁处于A、B、C三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:

(1) FeCl3溶液与黄铜矿发生反应的离子方程式为___________________________________________。
(2)向溶液1中加入过量铁粉的目的是_______________________________________________。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是__________________________。

(4)实验室制备乳酸亚铁的装置如图所示。
①实验前通入N2的目的是_______________________________________。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是_______________________________________________。
(5)已知:
①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。


由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,________________________________________________________________________。(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com