
(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
(1)MgCl2(熔融)电解Mg+Cl2↑ (2)2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol
(3)50;抑制SnCl2水解 (4)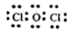 ;2HClO光照2H++2Cl-+O2↑
;2HClO光照2H++2Cl-+O2↑
(5)Al-3e-+4OH-=AlO2-+2H2O
解析试题分析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为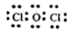 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等


科目:高中化学 来源: 题型:填空题
(12分)
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为 。

图1  图2
图2
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似。
①GaAs晶体中,每个As与 个Ga相连。
②第一电离能:As Se(填“>”、“<”或“=”)。
(4)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修3:物质结构与性质】(15分)
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
请回答下列问题:
(1)C-的电子排布式为______________;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N—B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是 。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为 。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)氧、硫、氯是中学化学重点研究的非金属元素,回答下列问题:
⑴三种元素形成的常见氢化物中稳定性最差的是_______,沸点最高的是____,其沸点最高的主要原因是________。
⑵硫单质与铁在加热时反应的方程式是_______,通过硫和氯的单质分别与铁的反应对比,从氧化还原角度可以得出的结论是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)四种主族元素的性质或结构信息如下:
| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。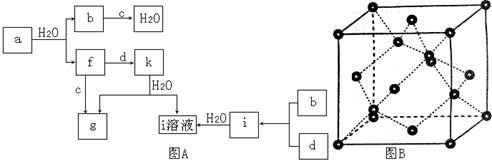
回答下列问题:
(1)图B对应的物质名称是 ,其晶胞中的原子数为 ,晶体的类型为 。
(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,原因是 ,该物质的分子构型为 ,中心原子的杂化轨道类型为 。
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,中心原子的杂化轨道类型为 ,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐N;丙、戊可组成化合物M。请回答下列问题:
(1)戊离子的结构示意图为 。
(2)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键的物质的结构式 ,该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反为 。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为 。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式 。
(5)按如图电解M的饱和溶液:
写出该电解池中发生反应的总反应方程式 。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com