
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡. I.已知H2A在水中存在以下平衡:H2AH++HA﹣ , HA﹣H++A2﹣ .
(1)NaHA溶液(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
(2)某温度下,0.1mol/L的NaHA溶液,下列关系中,一定正确的是 .
A.c(H+)c(OH﹣)=1×10﹣14
B.c(Na+)+c(H+)=c(HA﹣)+2c(A2﹣)
C.c(Na+)>c(HA﹣)>c(A2﹣)>c(H2A)
D.c(Na+)=c(HA﹣)+c(A2﹣)+c(H2A)
(3)已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0. ①降低温度时,Ksp(填“增大”、“减小”或“不变”,下同).
②滴加少量浓盐酸,c(Ca2+) .
③测得25℃时,CaA的Ksp为2.0×10﹣11 , 常温下将10g CaA固体投入100mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2﹣)=mol/L
(4)II.工业废水中常含有一定量的Cr2O72﹣和CrO42﹣ , 它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有还原沉淀法,该法的工艺流程为: CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
若平衡体系的pH=2,则溶液显色.
第②步中,还原1mol Cr2O72﹣离子,需要mol的FeSO47H2O.
第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至 .
【答案】
(1)无法确定
(2)D
(3)减小;增大;2×10﹣10
(4)橙;6;5
【解析】解:I.(1)H2A在溶液中部分电离属于弱酸,HA﹣的水解程度与电离程度关系不确定,所以NaHA溶液的酸碱性不能确定;
所以答案是:无法确定;(2)A.Kw与温度有关,温度不知道,所以c(H+)c(OH﹣)的值不确定,故A错误;
B.溶液中电荷守恒为:c(Na+)+c(H+)=c(HA﹣)+2c(A2﹣)+c(OH﹣),故B错误;
C.HA﹣的水解程度与电离程度关系不确定,c(A2﹣)与c(H2A)的大小关系不确定,故C错误;
D.0.1mol/L的NaHA溶液中,物料守恒为:c(Na+)=c(HA﹣)+c(A2﹣)+c(H2A),故D正确;
所以答案是:D;(3)①降低温度,抑制难溶物的电离,所以导致溶度积常数变小.
所以答案是:减小.
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动,所以钙离子浓度增大.
所以答案是:增大;
③已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2﹣)=2.0×10﹣11,则c(A2﹣)= ![]() mol/L=2.0×10﹣10mol/L,
mol/L=2.0×10﹣10mol/L,
所以答案是:2.0×10﹣10;
IIc(H+)增大,平衡2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O右移,溶液呈橙色,
所以答案是:橙;根据电子得失守恒:n(Cr2O72﹣)×6=n(FeSO47H2O)×1,n(FeSO47H2O)= ![]() =6mol,
=6mol,
所以答案是:6;当c(Cr3+)=10﹣5mol/L时,溶液的c(OH﹣)= ![]() =10﹣9 mol/L,c(H+)═
=10﹣9 mol/L,c(H+)═ ![]() =10﹣5mol/L,pH=5,即要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至5;
=10﹣5mol/L,pH=5,即要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至5;
所以答案是:5.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以硼镁泥为原料制取的硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2O的流程如下:

(1)实验中需用3 mol·L-1的硫酸500 mL,若用98%的浓硫酸(ρ=1.84 g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+反应,方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,
欲使2moL Mn2+被氧化则至少需要氧化剂NaClO质量为______g;还有一种离子也会被NaClO氧化,该反应的离子方程式为______________________________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有________、_________。
(4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100 g水):
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)若实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为86.1 g,则MgSO4·7H2O的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是________;电解质溶液Y是_________;
(2)银电极为电池的________极,发生的电极反应为__________________;X电极上发生的电极反应为________________________;
(3)外电路中的电子是从_______电极流向________电极。
(4)若电极X质量减少6.4g,则Ag极质量增加______ g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温泉有远古“圣水”之誉,富含各种对人体有益的微量元素及矿物质,水温高达56℃,水质淡黄清澈,享有“一盆玉汤”的美誉,对治疗皮肤病、色斑、关节炎及神经衰弱等有特殊的疗效.下列元素在生物体内含量较少,但对维持生物体正常生命活动必不可少的元素是( )
A. Fe Mn Zn Mg B. Zn Cu Mg Ca C. Zn Cu B Mn D. Mg Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
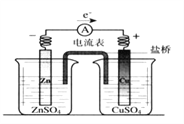
A. 铜片上有气泡逸出
B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液
D. 反应前后铜片质量不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶和ATP的叙述,错误的是( )
A. ATP中的A代表腺嘌呤,T代表 3,P代表磷酸基团
B. ATP 脱去2个磷酸基团后是RNA的基本组成单位之一
C. 酶促反应速率往往受温度、pH和底物浓度等因素的影响
D. 人体内的酶不能通过食物获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ = 2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A. 实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B. 实验②能说明氧化性:Cr2O72-> Fe3+
C. CrO42-和Fe2+在酸性溶液中可以大量共存
D. 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。工业上,利用乙烯水化法制乙醇:CH2=CH2+H2O![]() CH3CH2OH。下列有关说法正确的是
CH3CH2OH。下列有关说法正确的是
A. 1mol乙烯和1mol乙醇分别完全燃烧,消耗O2的分子数均为3NA
B. 1mol H2O和H2F+的混合物中所含质子数为10NA
C. 乙醇催化氧化生成1mol乙醛时转移电子数为NA
D. 46g乙醇中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物的说法正确的是( )
A.干冰的主要成分是H2O
B.SO2可大量用于漂白食品
C.吸入CO可导致人体中毒
D.小苏打的主要成份是Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com