
����Ŀ�����ڿ����о��õ���Ƭ 5.0 gͶ��ʢ��500mL0.5mol��L-1������Һ���ձ��У�����Ƭ�����ᷴӦ��������������v�뷴Ӧʱ��t�������ҵ�������������ʾ������������������

A.t��0��a�β�������������Ϊ��������������������������Һ
B.t��b��c�β����������������ӽϿ����Ҫԭ��֮һ���¶�����
C.t=cʱ��Ӧ��ƽ��״̬
D.t>c�������������ʽ�����Ҫ����Ϊ��Һ��c(H+)����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4����ɫҺ̬���ʣ���ϩ�����顢���ͼױ����������и���Ҫ��ķֱ��ǣ�
(1)��������ˮ������KMnO4��Һ��Ӧ����______________________��
(2)��������ˮ������KMnO4��Һ��Ӧ��������м����������Һ�巴Ӧ����___________�����ɵ��л���������________����Ӧ�Ļ�ѧ����ʽΪ_____________���˷�Ӧ����________��Ӧ��
(3)������ˮ������KMnO4��Һ��Ӧ����__________________��
(4)������ˮ��Ӧ����������KMnO4��Һ��Ӧ����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨCO2����Է���������ijʵ��С����λͬѧѡ�ú�NaHCO3����Ʒ(������Ϊm1g)�������������Լ�����������������ʵ�顣���������գ�
����������ȷ��CO2��������װ������ͼ��

(1)B�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________________________��
(2)ʵ���г�������ͨ�������������֮һ�ǰ����ɵ�CO2ȫ���������װ���У�ʹ֮��ȫ�����գ���������Ϊ___________________________________________________________��
(3)������߲ⶨ��ȷ�ȵĴ�ʩ��___________��
a����B�ڼ�����֮ǰ���ž�װ���ڵ�CO2����
b����B�ڵμ���ʱ���˹���
c����B��C֮������ʢ�б���NaHCO3��Һ��ϴ��װ��
d����D������ʢ�м�ʯ�ҵĸ����
���õζ���ȷ��CO2�����ʵ���������Ʒ���Ƴ�100mL��Һ������ȡ��20.00 mL����c mol��L��1������ζ�(������ָʾ��)����______________________________________________________ʱ��ֹͣ�ζ���ƽ�вⶨ���Σ��й�ʵ�����ݼ�¼���±���m1 g��Ʒ����CO2�����ʵ���Ϊ_____________��
ʵ���� | ����Һ��� (mL) | �����������(mL) | |
������ | ĩ���� | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
�������������ȷ��CO2�������װ����ͼ��ʾ��
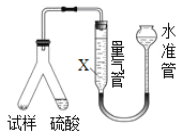
(4)Ϊ�˼�Сʵ�����������м����Һ��XΪ___________________��Һ��
(5)����װ�����������ã�����ƽ�ӣ�����õ���CO2�����������ȻƫС����ԭ�������____________________________________________________________________________��
(6)ȷ��CO2����Է���������ѡ��___________________(��������������������������������д)��ʵ������Ϊ��ѡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ����Ԫ�أ�����
����Ԫ�أ�����![]() ��
��![]() ��
��![]() ����ͬһ���ڣ�
����ͬһ���ڣ�![]() ԭ��������
ԭ��������![]() �ܼ����������ڴ����ĵ���������
�ܼ����������ڴ����ĵ���������![]() ԭ�����������2��δ�ɶԵ��ӡ���֪
ԭ�����������2��δ�ɶԵ��ӡ���֪![]() ��
��![]() ��
��![]() ԭ�Ӻ��ڵ�������������������ȣ���
ԭ�Ӻ��ڵ�������������������ȣ���![]() Ԫ�ؿɷֱ���
Ԫ�ؿɷֱ���![]() ��
��![]() ��
��![]() ��
��![]() ����
����![]() �ͻ������
�ͻ������![]() �У�
��![]() ��
��![]() ��������Ϊ
��������Ϊ![]() ����
����![]() ��
��![]() ��
��![]() ��������Ϊ
��������Ϊ![]() ����ش��������⣺
����ش��������⣺
��1���![]() ��
��![]() ����Ԫ�ص�Ԫ�ط��ţ�
����Ԫ�ص�Ԫ�ط��ţ�![]() ______��
______��![]() ______��
______��
��2��д��![]() Ԫ��ԭ�ӵĵ����Ų�ʽ��______��
Ԫ��ԭ�ӵĵ����Ų�ʽ��______��
��3��ָ��![]() ��Ԫ�����ڱ��е�λ�ã�______��
��Ԫ�����ڱ��е�λ�ã�______��
��4���Ƚ�![]() ��
��![]() ��
��![]() ����Ԫ�صĵ�һ�����ܵĴ�С��______����Ԫ�ط��ţ���ͬ����
����Ԫ�صĵ�һ�����ܵĴ�С��______����Ԫ�ط��ţ���ͬ����
��5���Ƚ�![]() Ԫ�غ�
Ԫ�غ�![]() Ԫ�صĵ縺�Ե���Դ�С��______��
Ԫ�صĵ縺�Ե���Դ�С��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Na2CO3�������������о��й㷺����;����ͼ1��ʵ����ģ���Ƽ�ԭ����ȡNa2CO3������ͼ��
���������գ�
��֪�������к���Ca2+��Mg2+��SO42�����������ӣ�
��1�����Ƴ��ӵIJ���˳����____��___��____��____��____ ������ĸ��ţ���
a �����ܽ� b ���������pH c ����Ba��OH��2��Һ d ����Na2CO3��Һ e ����
��2����ʳ��ˮ����ͨ��NH3����ͨ��CO2��������______������Һa��ͨ��NH3�ͼ��뾫�ε�Ŀ����______��
��3������ͼ1����ͼ��������������ѭ����·�ߣ�____

��4��ͼ2װ���г�����ʵ�����Ʊ�CO2����__������ĸ��ţ�����cװ���Ʊ�NH3����ƿ�ڿɼ�����Լ���___�����Լ����ƣ���
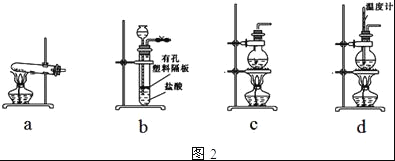
��5��һ����Ȼ���ɷ���aNa2CO3bNa2SO4cH2O�����������ṩ���Լ�����ƲⶨNa2CO3����������ʵ�鷽�������ʵ�鷽������������
��ѡ����Լ���ϡH2SO4��BaCl2��Һ��ϡ��ˮ����ʯ�ҡ�Ba��OH��2��Һ
��______��
��______��
��______��
�ܼ�����Ȼ����к�Na2CO3������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡���ѹ�£���һ���ݻ��ɱ�������з������·�Ӧ��A(g)+B(g)C(g)
(1)����ʼʱ����1 mol A��1 mol B���ﵽƽ�������amol C����ʱA�����ʵ���Ϊ__mol��
(2)����ʼʱ����3 mol A��3 mol B���ﵽƽ�������C�����ʵ���Ϊ__mol
(3)����ʼʱ����xmol A��2 mol B��1 mol C���ﵽƽ���A��C�����ʵ����ֱ�Ϊymol��3amol����x=__��y=__��ƽ��ʱ��B�����ʵ���__(����)��
A.����2 mol B.����2 mol C.С��2 mol D.���ܴ��ڡ����ڻ�С��2 mol
(4)����(3)��ƽ���������ټ���3 mol C�����ٴδﵽƽ���C�����ʵ���������__��
(5)��ά���¶Ȳ��䣬��һ���뷴Ӧǰ��ʼ�����ͬ�����ݻ��̶��������з���������Ӧ����ʼʱ����1 mol A��1 mol B����ƽ�������bmol C����b��(1)С���е�a���бȽ�__(����)���������жϵ�������__��
A.a��b B.a��b C.a=b D.���ܱȽ�a��b�Ĵ�С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ����Ƴɶ�����;�ĵ绯ѧװ�á����з�����ȷ����
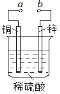
A.��a��b�õ�������ʱ����Һ�е�SO42����ͭƬ�����ƶ�
B.��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��2H++2e ��H2��
C.��a���Դ�����������Ա���пƬ������������������������
D.a��b�õ������Ӻ�·��ͨ��0.02 mol����ʱ������0.02 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶��ݻ����ܱ������У����淴Ӧ��H2(g) + I2(g) ![]() 2HI (g)�ﵽƽ��ı�־��( )
2HI (g)�ﵽƽ��ı�־��( )
��H2��I2��HI�ķ�����֮��Ϊ1��1��2
�����������ܶȱ��ֲ���
����λʱ���γ�n mol H��H����ͬʱ�γ�2n mol H��I��
������������ɫ���ٷ����仯
����������ƽ����Է����������ٷ����仯
������ѹǿ���ٷ����仯
��H2������������ٷ����仯
A.�٢ڢܢ�B.�ۢ�C.�ۢܢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ǽ�����Methylnene Blue���ڼ��������������������������Ǽ��ף�Methylene White�����Ǽ����Ľṹ��ʽ��
��������ƿ��ʵ������������£�
����ͼʾ��250mL��ƿ�У����μ���2g NaOH��100mL H2O��3g�����ǣ������ܽ���ټ���3�Ρ�5��0.2%���Ǽ�����Һ�����Һ������ɫ��
��������Ƥ��������a��b�رգ�������Һ���ã���Һ��Ϊ��ɫ��
���ٴ�ƿ��������Һ�ֱ�Ϊ��ɫ��
����������Ƥ��������Һ���ã���Һ�ֱ�Ϊ��ɫ�����Ϣۡ��ܿ��ظ���Ρ�
�Իش��������⣺

��1��ijѧ���������õ���ɫ��Һ��װ��A��B��֧�Թ��У�����ͼ��A�Թܳ�����Һ��B����������Һ����������Ƥ������Ƭ�̣�����Һ������ɫ������ͬʱ��A��B�Թܣ�������ɫ����_________������A������B������
��2����������ƿ��������a��b��ͨ�������������ٹرջ���a��b������Һ�ܷ�����ɫ��Ϊ��ɫ_________��������������������������������ƿ������a��bͨ��������������Һ�ܷ�����ɫ��Ϊ��ɫ_________������������������������
��3������ת�������У������ǵ�������_________���Ǽ�����������_________��
��4������ʵ����������Ҳ�����ʳ�֭�����к��ḻά����C�����棬������Ϊά����C����_____��
��5����ʵ���Тۡ��ܲ����ܷ������ظ�����_________�����������������������������ǡ�_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com