
【题目】为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验。完成下列填空:
甲用重量法确定CO2的质量,装置如下图:

(1)B中反应的化学方程式为____________________________________________________。
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为___________________________________________________________。
(3)不能提高测定精确度的措施是___________。
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
乙用滴定法确定CO2的物质的量,将样品配制成100mL溶液,从中取出20.00 mL,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当______________________________________________________时,停止滴定。平行测定三次,有关实验数据记录如下表。m1 g样品产生CO2的物质的量为_____________。
实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
初读数 | 末读数 | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
丙用气体体积法确定CO2的体积,装置如图所示。
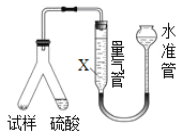
(4)为了减小实验误差,量气管中加入的液体X为___________________溶液;
(5)若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是____________________________________________________________________________。
(6)确定CO2的相对分子质量,选用___________________(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳。
【答案】2NaHCO3+H2SO4=Na2SO4+CO2↑+H2O 搅拌B、C中的反应物,使反应充分进行 c 滴入1滴盐酸,溶液刚好由黄色变橙色,且半分钟内不变色 0.125c mol 饱和碳酸氢钠 测定气体体积时水准管的液面高于量气管的液面或有CO2溶解在水中或其他合理的答案 甲和乙
【解析】
空气进入装置A中,氢氧化钠吸收空气中的二氧化碳,排除空气中的气体对实验的干扰;锥形瓶中发生碳酸氢钠与酸的反应,产生大量二氧化碳,持续缓缓通入空气,把生成的CO2全部排入后续装置中,经过装置C时,将制得的二氧化碳干燥,最后通入碱石灰中,通过碱石灰增重,计算生成二氧化碳的质量。
(1)B中发生碳酸氢钠与酸的反应,反应的化学方程式2NaHCO3+H2SO4=Na2SO4+CO2↑+H2O;
(2)装置A中的出气导管伸入装置B的液面以下,实验中持续缓缓通入空气,把生成的CO2全部排入后续装置中,使之完全被吸收;通过气体翻动反应液体,搅拌B、C中的反应物,使反应充分进行;
(3) a.向B内加入酸之前,排尽装置内的CO2气体,保证最后吸收的气体完全由反应制备,提高反应精确度;
b.向B内滴加酸时不宜过快,使碳酸氢钠与酸充分反应,提高反应效率;
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置对反应结果无作用,此反应不需要收集二氧化碳,不用饱和碳酸氢钠溶液;
d.在D后增添盛有碱石灰的干燥管,保证气体被彻底吸收,确保实验结果准确。
综上所述,不能提高测定精确度的措施是c。
乙用滴定法确定CO2的物质的量,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当滴入1滴盐酸,溶液刚好由黄色变橙色,且半分钟内不变色时,停止滴定。平行测定三次,由表可知,待测液20ml,消耗盐酸平均25ml,根据反应方程式NaHCO3+HCl=NaCl+CO2↑+H2O,m1 g样品产生CO2的物质的量![]() ;
;
丙用气体体积法确定CO2的体积,用连通器原理,通过收集二氧化碳气体,计算气体体积。 (4)为了减小实验误差,降低溶液对二氧化碳的吸收,量气管中加入的液体X为饱和碳酸氢钠溶液;
(5)若该装置气密性良好,但测得的“CO2体积”数据仍然偏小,其原因可能是测定气体体积时水准管的液面高于量气管的液面或有CO2溶解在水中;
(6)甲、乙实验可以计算气体质量,而丙实验只能知道气体体积和物质的量,故确定CO2的相对分子质量,选用甲、乙的实验数据为最佳。


科目:高中化学 来源: 题型:
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=____。酸碱按体积比为1:10混合后溶液显中性,则a+b=____________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为__________mo1·L–l,B溶液中水电离出的氢离子浓度为____________mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA _____________VB,混合后溶液中的离子浓度关系为c(Na+)___________c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构简式及球棍模型如图所示:
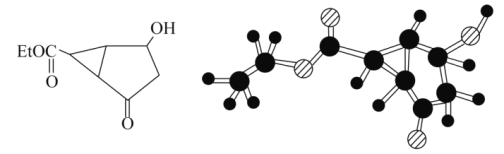
该有机物分子的核磁共振氢谱图如下。下列关于该有机物的叙述正确的是( )
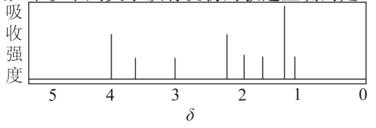
A.该有机物有8种不同化学环境的氢原子
B.该有机物属于芳香化合物
C.该化合物结构简式中的![]() 代表的基团为
代表的基团为![]()
D.该有机物在一定条件下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。

已知:A的分子式为C5H8O,它有两种不同环境的氢原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的结构简式为________________________________。
(2)D中官能团的名称为____________________________。
(3)检验M已完全转化为N的实验操作是___________________________________________。
(4)E与浓硫酸共热可制得H,H可制备一种高分子化合物Q。写出Q的结构简式_________。
(5)写出满足下列条件的L的两种同分异构体的结构简式(不考虑立体异构):__________。
①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(6)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
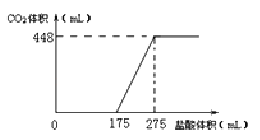
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaOH与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是

A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.0mol PCl3和2.0mol Cl2充入体积不变的密闭容器中,一定条件下发生下述反应:PCl3(g)+Cl2(g) ![]() PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
PCl5(g) 达到平衡后,PCl5为0.8 mol,如果此时再充入4.0mol PCl3和2.0mol Cl2,相同温度下再达到平衡时PCl5的物质的量是( )
A.1.6molB.小于1.6molC.0.8molD.大于1.6mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com