
【题目】已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=____。酸碱按体积比为1:10混合后溶液显中性,则a+b=____________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为__________mo1·L–l,B溶液中水电离出的氢离子浓度为____________mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA _____________VB,混合后溶液中的离子浓度关系为c(Na+)___________c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_________________。
【答案】7 13 10-10 10-12 < = M++H2O![]() MOH+H+
MOH+H+
【解析】
A溶液中的c(H+)=10-amol·L-1,B溶液中的c(H+)=10-bmol·L-1,B溶液中的c(OH-)=10b-14mol·L-1
(1)盐酸是强酸,氢氧化钡是强碱,a+b=14时,若a=1,则b=13,两溶液等体积混合,溶液呈中性,即pH=7;若酸碱体积比为1:10,则有1×10-a=10×10b-14,即-a=b-14+1,即a+b=13;
(2)若A为醋酸,A溶液中的H+主要来自于醋酸的电离,则水电出的H+的浓度与OH-的浓度相同,都是![]() =
=![]() =10-10mol/L;B为氢氧化钠,溶液中H+主要来自于水的电离,其浓度为10-bmol/L=10-12mol/L;
=10-10mol/L;B为氢氧化钠,溶液中H+主要来自于水的电离,其浓度为10-bmol/L=10-12mol/L;
(3)醋酸是弱酸,氢氧化钠是强碱,a+b=14,则a=b-14,即醋酸溶液中H+的浓度和氢氧化钠溶液中OH-的浓度相同;若两种溶液等体积混合,则混合后溶液呈酸性,所以要想使溶液呈中性,要适当减少酸的体积或增加碱的体积,即VA<VB;根据电荷守恒,有c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于溶液呈中性,即c(H+)=c(OH-),所以c(Na+)=c(CH3COO-);
(4)由于a+b=14,则a=b-14,即HR溶液中H+的浓度和MOH溶液中OH-的浓度相同;两者等体积混合后,溶液呈碱性,则MOH一定是弱碱,HR可能是强酸,也可能是弱酸(但HR电离常数要大于MOH),由于必定有一种离子发生水解,所以该离子一定是M+,其水解的离子方程式为:M++H2O![]() MOH+H+。
MOH+H+。


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】有两种短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() 。
。
(1)推断元素名称和符号:![]() _______、______,
_______、______,![]() ______、_______。
______、_______。
(2)![]() 、
、![]() 两元素形成的化合物可能具有的性质是_______(填序号)。
两元素形成的化合物可能具有的性质是_______(填序号)。
A.能与水反应 B.能与硫酸反应 C.能与氢氧化钠溶液反应
(3)![]() 元素的原子含有_______个能层,Y元素的原子含有_______个能层。
元素的原子含有_______个能层,Y元素的原子含有_______个能层。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料,合成某些高聚物的路线如图:

已知:Ⅰ.![]() (或写成
(或写成![]() R代表取代基或氢)
R代表取代基或氢)
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2请完成以下问题:
(1)CH3CH=CHCH3的名称是______,Br2的CCl4溶液呈______色.
(2)X→Y的反应类型为:______;D→E的反应类型为:______.
(3)H的结构简式是______.
(4)写出下列化学方程式:
A→B______;
Z→W______.
(5)化工生产表明高聚物H的产率不及设计预期,产率不高的原因可能是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种无色液态物质:己烯、己烷、苯和甲苯,符合下列各题要求的分别是:
(1)不能与溴水或酸性KMnO4溶液反应的是______________________。
(2)不能与溴水或酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是___________,生成的有机物名称是________,反应的化学方程式为_____________,此反应属于________反应。
(3)能与溴水或酸性KMnO4溶液反应的是__________________。
(4)不与溴水反应但能与酸性KMnO4溶液反应的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A. 4种溶液pH的大小顺序:①>④>③>②
B. 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C. 向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D. 向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用芳香族化合物A制取有机物F的合成路线如下:

回答下列问题:
(1)A的分子式为____________,B→C的反应类型为________。
(2)足量的D与Na2CO3溶液发生反应的化学方程式:__________。
(3)E的结构简式为___________________________。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出上述合成路线中含有手性碳的物质结构简式并用星号( * )标出手性碳:__________________________。
(5)芳香族化合物M与A互为同分异构体,且M能发生银镜反应.则M的结构有_____种(不考虑立体异构);其中核磁共振氢谱显示有4种不同化学环境的氢且峰面积之比为6: 2: 1 : 1的结构简式有________(任写-种)。
(6)结合已知信息写出用1-溴丙烷和苯为原料制备![]() 的合成路线(其他试剂任选)。_______________。
的合成路线(其他试剂任选)。_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的同分异构体数目判断错误的是( )
选项 | 有机物 | 同分异构体数目 |
A | 分子式为 | 3 |
B | 分子式为 | 5 |
C | 分子式为 | 4 |
D | 分子式为 | 3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验。完成下列填空:
甲用重量法确定CO2的质量,装置如下图:

(1)B中反应的化学方程式为____________________________________________________。
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为___________________________________________________________。
(3)不能提高测定精确度的措施是___________。
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
乙用滴定法确定CO2的物质的量,将样品配制成100mL溶液,从中取出20.00 mL,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当______________________________________________________时,停止滴定。平行测定三次,有关实验数据记录如下表。m1 g样品产生CO2的物质的量为_____________。
实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
初读数 | 末读数 | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
丙用气体体积法确定CO2的体积,装置如图所示。
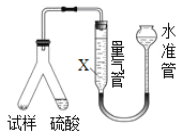
(4)为了减小实验误差,量气管中加入的液体X为___________________溶液;
(5)若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是____________________________________________________________________________。
(6)确定CO2的相对分子质量,选用___________________(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图可设计成多种用途的电化学装置。下列分析正确的是
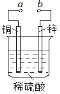
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.当a和b用导线连接时,铜片上发生的反应为:2H++2e →H2↑
C.将a与电源正极相连可以保护锌片,叫牺牲阳极的阴极保护法
D.a和b用导线连接后,电路中通过0.02 mol电子时,产生0.02 mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com