
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、伴有能量变化的物质变化都是化学变化 |


科目:高中化学 来源: 题型:
| A、反应中,三种金属中有两种金属过量 |
| B、参加反应的金属Na、Mg、Al的物质的量之比为6:3:2 |
| C、镁的物质的量为0.1mol |
| D、V=2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
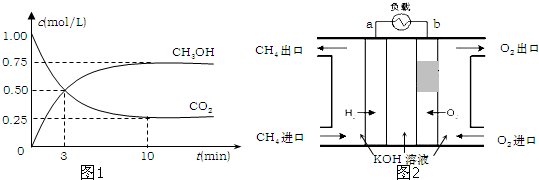
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、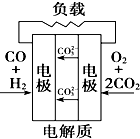 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B、需要95 mL 0.1 mol?L-1NaCl溶液,可选用100 mL容量瓶来配制 |
| C、用100 mL的量筒量取5.2 mL的盐酸 |
| D、用托盘天平称取25.20 g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、100mL0.1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4 L |
| D、48gO2和O3的混合气体中氧原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com