
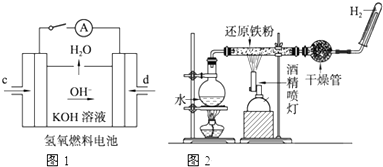
分析 ①根据氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水;
②根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子.
解答 解:①氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,反应式为H2-2e-+2OH-=2H2O.
故答案为:H2-2e-+2OH-=2H2O;
②铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,
离子方程式为:2Fe3++Fe=3Fe2+,所以说不严密.
故答案为:不严密; 产物中含+3价铁的物质与稀硫酸反应后生成Fe3+,Fe3+可与过量的Fe反应生成Fe2+,2Fe3++Fe═3Fe2+.
点评 本题考查了电化学知识.易错点是氢氧燃料电池中电极的判断,明确溶液中离子的移动方向是解此题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
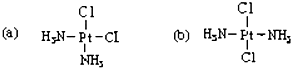 科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )
科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只显红色 | B. | 呈无色 | C. | 无色或蓝色 | D. | 红色或无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度.NaOH溶液的起始温度和反应后反应体系的最高温度 | |
| C. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 | |
| D. | 某可逆反应的化学平衡常数K,只随温度的改变而改变,且温度越高K值一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质中都只含C、H、O三种元素 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉、纤维素分子组成都可表示为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备肥皂,利用花生油与稀硫酸混合液在小烧杯中加热,直到油滴消失 | |
| B. | 配置菲林试剂,在硫酸铜溶液中加入少量的氢氧化钠溶液 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别汽油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com