
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
A.v正(NH3)=2v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
科目:高中化学 来源: 题型:
【题目】草酸H2C2O4为二元弱酸,Kal(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5)。室温下向0.lmol·L-l的Na2C2O4溶液中缓慢通入HCl气体直至过量(忽略溶液体积变化和HCl的挥发)。该过程中得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.lmol·L-lNa2C2O4溶液:c(Na+)>c(C2O![]() )>c(HC2O
)>c(HC2O![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.pH=7的溶液:c(Na+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )
)
C.c(C2O![]() )=c(HC2O
)=c(HC2O![]() )的溶液:c(Cl-)>c(C2O
)的溶液:c(Cl-)>c(C2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
D.c(Na)=2c(Cl-)的溶液:c(Na+)+c(H+)>c(Cl-)+c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)+c(OH-)
)+c(H2C2O4)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图配制450mL1.00 mol·L-1 NaOH溶液的示意图,下列说法正确的是

A.图①中应称得NaOH 18.0 g
B.未进行④和⑤的操作,所配溶液浓度将偏大
C.定容后把容量瓶倒置摇匀,发现液面低于刻度线不必再加水至刻度线
D.步骤②后应将溶液立即转移到容量瓶中,防止药品变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究潮湿的Cl2与Na2CO3反应的产物,进行如下实验根据设计要求回答:
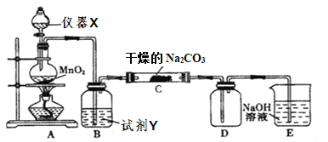
⑴X仪器名称是____________。
⑵装置A中发生反应的离子方程式:____________。
⑶B装置中试剂Y的作用是____________。
⑷下列有关该实验的说法中,不正确的是____________。
A.如图组装好实验仪器后,要先检查装置气密性,后添加药品
B.E装置的作用是吸收尾气防止污染空气
C.装置C中Cl2与Na2CO3以等物质的量反应,且生成的气体产物仅为Cl2O,可知反应方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑
D.试剂Y是浓硫酸,目的是干燥氯气
⑸设计实验方案验证C中生成的固体中存在![]() ____________。
____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,某研究小组采用如下路线合成X和一种常见的高分子化合物D。首先合成D和乙醇,线路如下:
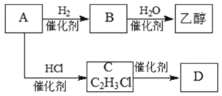
(1)已知A是一种常见的气态烃。写出A分子的结构式________________。
![]() 的化学方程式________________,该反应的类型是:________________。
的化学方程式________________,该反应的类型是:________________。
(2)写出化合物B的结构简式________________,实验室制取B反应的化学方程式:________________。乙醇中官能团的名称是:________。
进一步合成X线路如下:
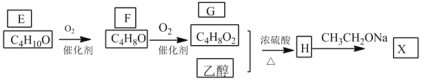
已知:①化合物E的结构中有2个甲基
②![]()

(3)若G中混有F,可以用来检验的试剂是________________,反应的化学方程式为________________。
(4)写出![]() 的化学方程式是________________;反应类型是________。
的化学方程式是________________;反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氯气生产某些含氯有机物时会产生副产物氯化氢。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:①反应A中,4 mol氯化氢被氧化,放出115.6 kJ的热量。
②
(1)断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,
(2)水分子中H—O键比氯化氢分子中H—Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
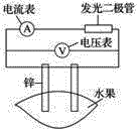
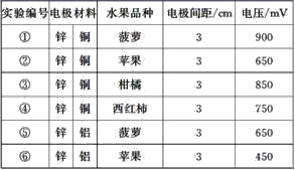
请回答以下问题:
(1)实验⑥中负极的电极反应式为_____________。
(2)实验①、⑤中电流方向相反的原因是_________。
(3)影响水果电池电压的因素有________、________。
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com