
【题目】化合物X是一种有机合成中间体,某研究小组采用如下路线合成X和一种常见的高分子化合物D。首先合成D和乙醇,线路如下:
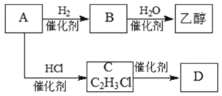
(1)已知A是一种常见的气态烃。写出A分子的结构式________________。
![]() 的化学方程式________________,该反应的类型是:________________。
的化学方程式________________,该反应的类型是:________________。
(2)写出化合物B的结构简式________________,实验室制取B反应的化学方程式:________________。乙醇中官能团的名称是:________。
进一步合成X线路如下:
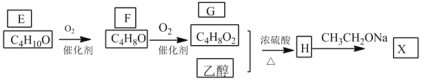
已知:①化合物E的结构中有2个甲基
②![]()

(3)若G中混有F,可以用来检验的试剂是________________,反应的化学方程式为________________。
(4)写出![]() 的化学方程式是________________;反应类型是________。
的化学方程式是________________;反应类型是________。
【答案】H-C≡C-H ![]() 加聚反应
加聚反应 ![]()
![]() 羟基 新制
羟基 新制![]() 悬浊液
悬浊液 ![]()
 取代
取代
【解析】
A是一种常见的气态烃,与HCl反应得到C2H3Cl,可推知A为HC≡CH,则C为CH2=CHCl,高分子化合物D为![]() .乙炔与氢气反应生成B,B与水反应得到乙醇,故B为CH2=CH2.化合物E的结构中有2个甲基,其分子式为C4H10O,可以连续发生氧化反应,可推知E为
.乙炔与氢气反应生成B,B与水反应得到乙醇,故B为CH2=CH2.化合物E的结构中有2个甲基,其分子式为C4H10O,可以连续发生氧化反应,可推知E为![]() ,顺推可知F为
,顺推可知F为![]() 、G为
、G为![]() 、H为
、H为![]() ,结合题目中信息②中的取代反应,可推知X为
,结合题目中信息②中的取代反应,可推知X为 ,反应同时还会生成CH3CH2OH。
,反应同时还会生成CH3CH2OH。
(1)由上述分析,可知A为乙炔,其结构式为:H-C≡C-H,C→D是氯乙烯发生加聚反应生成聚氯乙烯,反应的化学方程式是:![]() ;
;
(2)化合物B的结构简式为:CH2=CH2,实验制取B反应的化学方程式:![]() ,乙醇中官能团的名称是:羟基,
,乙醇中官能团的名称是:羟基,
(3)若G中混有F,F中含有醛基,可以新制氢氧化铜检验,实验方案为:取少量待测液于试管中,先加入足量的氢氧化钠溶液,再加入新制的氢氧化铜悬浊液,加热,如有砖红色沉淀产生,则证明G中混有F;反应的化学方程式为![]() ;
;
(4)H→X的化学方程式是: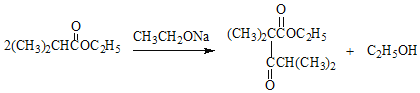 ,属于取代反应。
,属于取代反应。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】一种镁氧电池电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液,如图所示。下列说法不正确的是( )
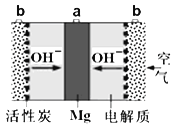
A.正极反应式为:O2+4e-+2H2O=4OH-
B.负极反应式为:Mg-2e-+2OH-=Mg(OH)2
C.电子的移动方向是由a经外电路到b
D.该电池在工作过程中,电解液KOH的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
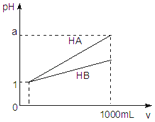
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.pH相同的HA、HB溶液,物质的量浓度HA<HB
C.若1<a<4,则HA、HB都是弱酸
D.体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验
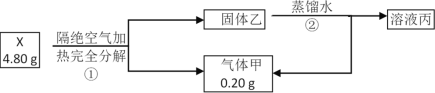
请回答:
(1)X的电子式是____________
(2)固体乙所含元素在元素周期表中的位置____________。
(3)写出X与水反应的化学方程式____________。
(4)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
A.v正(NH3)=2v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。完成下列填空:
(1) 实验室配制氯化铝溶液时加入盐酸的目的是____________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是______(填编号)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6-n),为确定n的值,取3.490g白色固体,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等价,进行如下实验:
(3)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g。判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧_______次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定A12O3的质量的原因可能是____(选填编号)。
a 干燥Al(OH)3固体时易失水 b Al2O3的质量比Al(OH)3大,误差小
c 沉淀Al(OH)3时不完全 d 灼烧氧化铝时不分解
(4)从另一份溶液中取出20.00 mL,用0.1290 mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数__________mL,Al2(OH)nCl(6-n)中n的值为__________。
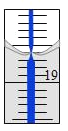
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
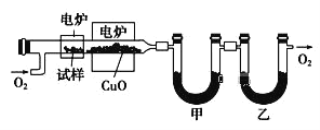
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3(如图Ⅰ)
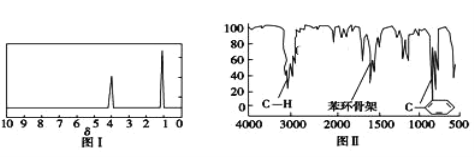
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_____。
(2)X的分子式为_____;X的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质变化,只与范德华力有关的是___。
A.干冰熔化 B.乙酸汽化 C.乙醇溶于水 D.碘溶于四氯化碳
(2)下面是s能级与p能级的原子轨道图:
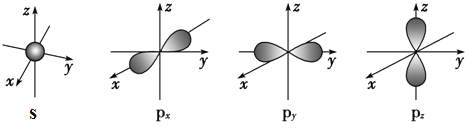
请回答下列问题:
s电子的原子轨道呈__形,每个s能级有__个原子轨道;p电子的原子轨道呈___形,每个p能级有___个原子轨道.
(3)Na、Mg、Al第一电离能的由大到小的顺序:___。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com