
【题目】在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在曲线的A、B间,溶液中可能有![]()
B.在B点,![]() ,且有
,且有![]()
C.在C点,![]()
D.在D点,![]()
【答案】A
【解析】
根据题给信息及图可知,在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液pH逐渐减小,B点时,溶液呈中性,D点时,
溶液,溶液pH逐渐减小,B点时,溶液呈中性,D点时,![]() 消耗一半,此时
消耗一半,此时![]() 和
和![]() 浓度相等。
浓度相等。
A. 在A、B间任一点,溶液中只存在四种离子有![]() 、
、![]() 、
、![]() 、
、![]() ,根据电荷守恒有:
,根据电荷守恒有:![]() ,因为
,因为![]() ,所以
,所以![]() ,当加入的
,当加入的![]() 量逐渐增加,使得
量逐渐增加,使得![]() 时,便出现溶液中离子浓度大小关系为:
时,便出现溶液中离子浓度大小关系为:![]() ,故A正确;
,故A正确;
B. 在B点溶液显中性,则结果是![]() ,根据电荷守恒
,根据电荷守恒![]() ,则一定有
,则一定有![]() ,溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:
,溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:![]() ,故B错误;
,故B错误;
C. 在C点,溶液显酸性,故有![]() ,根据电荷守恒:
,根据电荷守恒:![]() ,故
,故![]() ,故C错误;
,故C错误;
D. 在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等,均为![]() ,根据物料守恒,有:
,根据物料守恒,有:![]() ,故D错误;
,故D错误;
答案选A。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g)
CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g) ![]() 1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法错误的是![]()
A.开发太阳能、风能、地热能、潮汐能等新能源可以减少霾的产生
B.硅胶可用作商品包装袋内的干燥剂,也可以用作催化剂的载体
C.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
D.燃烧法可以鉴别羊毛和棉线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧银锌纽扣电池(含Zn、Ag、石墨及少量Hg、Mn等)的正极片中回收银的工艺流程如下:
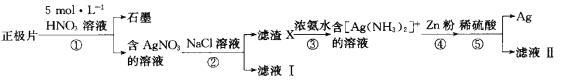
下列说法错误的是( )
A.①中会产生对大气有污染的气体
B.③的离子方程式为Ag++2NH3·H2O =[Ag(NH3)2] ++2H2O
C.⑤中加稀硫酸的目的是除去银粉中的锌
D.合理处理废旧电池有利于保护环境和资源再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
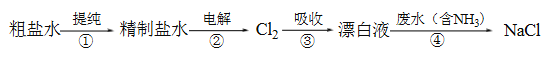
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.56gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法不正确的是( )
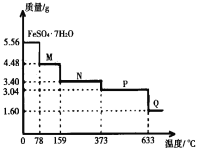
A.温度为78℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是

A. 图甲表示:向某明矾溶液中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与滴加NaOH溶液体积的关系
B. 图乙表示:向含等物质的量的NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量,生成气体的体积与滴加HCl溶液体积的关系
C. 图丙表示:在稀硝酸溶液中逐渐加入铁粉至过量,溶液中Fe3+物质的量与逐渐加入铁粉物质的量的变化关系
D. 除去混在硝酸钾中少量的氯化钠可用“蒸发浓缩、趁热过滤”的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 mol ·L-1的Q后会发生如下反应:2Q(g) ![]() M(g) 。其中M的物质的量浓度随时间的变化如图所示。
M(g) 。其中M的物质的量浓度随时间的变化如图所示。
下列说法错误的是
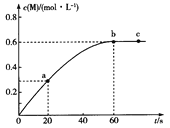
A.从反应开始到刚达到平衡时间段内,v(Q)=0.02 mol·L-1·s-1
B.a、b两时刻生成Q的速率:v(a)<v(b)
C.用Q浓度变化值表示的ab、bc两个时段内的反应速率:v(ab)>v(bc)=0
D.其他条件相同,起始时将0. 2 mol·L-1氦气与Q混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH=__kJ·mol-1
CH3OH(g) ΔH=__kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是__(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1__p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=__(mol·L-1)-2;
③在其它条件不变的情况下,再增加amolCO和2amolH2,达到新平衡时,CO的转化率__(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com