
【题目】化学与生产、生活密切相关,下列说法错误的是![]()
A.开发太阳能、风能、地热能、潮汐能等新能源可以减少霾的产生
B.硅胶可用作商品包装袋内的干燥剂,也可以用作催化剂的载体
C.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
D.燃烧法可以鉴别羊毛和棉线
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化曲线如图所示(其中C为有色气体),按要求解决下列问题。
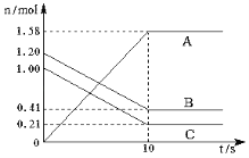
(1)该反应的化学方程式为____;
(2)用B表示的反应速率为____;
(3)下列条件改变时,能加快化学反应速率的是__请填代号)
A.扩大容器的容积 B.增大C的用量 C.降低体系的温度 D.加入催化剂
(4)该反应达到平衡状态的标志是________;
①2 v (A)=v (B) ②单位时间内生成n mol B的同时生成2n mol A ③A、B、C的浓度之比为2:1:1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变.
(5)该反应达到化学反应限度时,B的转化率为__。(请保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子数依次增加,由这些元素组成的常见物质的转化关系如图所示,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质能与沸水反应,且该单质可制造照明弹,f为固体单质。下列有关说法正确的是

A.简单离子半径:Y>Z>X
B.元素的非金属性:W>X
C.X、Y两种元素组成的化合物只含离子键
D.最高价氧化物对应水化物的碱性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
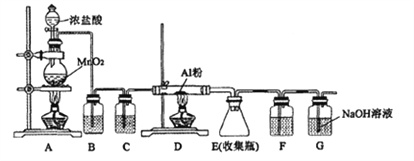
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b点溶液中各离子浓度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
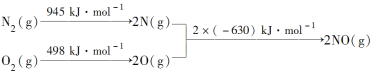
写出该反应的热化学方程式:____。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-=2O2-)。
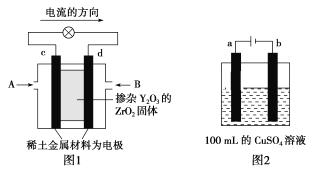
①c电极的名称为___,d电极上的电极反应式为____。
②如图2所示电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为___。若要使电解质溶液恢复到电解前的状态,可加入___(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为____。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。

①电源的负极为____(填“A”或“B”)。
②阳极室中发生的反应依次为___。
③电解结束后,阴极室溶液的pH与电解前相比将___(填“增大”“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___g(忽略气体的溶解)。
(5)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用____(填“氧化剂”或“还原剂”)与之反应。
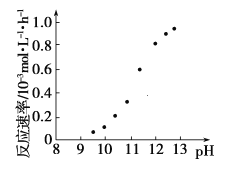
②某化学镀铜的反应速率随镀液pH变化如图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在曲线的A、B间,溶液中可能有![]()
B.在B点,![]() ,且有
,且有![]()
C.在C点,![]()
D.在D点,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )

A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com