
【题目】一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化曲线如图所示(其中C为有色气体),按要求解决下列问题。
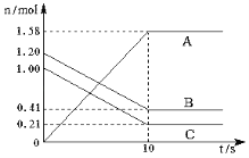
(1)该反应的化学方程式为____;
(2)用B表示的反应速率为____;
(3)下列条件改变时,能加快化学反应速率的是__请填代号)
A.扩大容器的容积 B.增大C的用量 C.降低体系的温度 D.加入催化剂
(4)该反应达到平衡状态的标志是________;
①2 v (A)=v (B) ②单位时间内生成n mol B的同时生成2n mol A ③A、B、C的浓度之比为2:1:1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变.
(5)该反应达到化学反应限度时,B的转化率为__。(请保留一位小数)
【答案】B(g)+C(g)2A(g) 0.0395mol/(Ls) BD )②④ 65.8%
【解析】
(1)由图像可知,10s之前,BC的量一直在减少,则BC为反应物,A的量一直在增加,则A为生成物,根据各物质变化的数据书写出该反应的化学方程式为:B(g)+C(g)2A(g);
(2)用B表示的反应速率为:![]() ;
;
(3)A.扩大容器的容积,三种气体的浓度都变小,该反应的化学反应速率减小,A不符合题意;
B.增大C的用量,则增大反应物的浓度,该反应的化学反应速率增大,B符合题意;
C.降低体系的温度,减小了该反应的反应速率,C不符合题意;
D.加入催化剂能加快反应的化学反应速率,D符合题意;
答案选BD;
(4)①2v (A)=v (B)未指明是正反应速率还是逆反应速率,而且等式两边的系数不对,不能说明反应达到平衡状态,①不符合题意;
②单位时间内生成n mol B代表的是逆反应速率,生成2n mol A代表的是正反应速率,且倍数相符,能说明反应达到平衡状态,②符合题意;
③各物质的浓度之比无法说明反应是否达到平衡状态,③不符合题意;
④C为有色气体,混合气体的颜色不再改变,说明反应达到平衡状态,④符合题意;
⑤体系中所有物质均为气体,容器的体积固定,所以混合气体的密度保持不变,所以混合气体的密度不再改变时不能说明反应达到平衡状态,⑤不符合题意;
⑥M(平均)=m总/n总,容器中气体的质量保持不变,反应物的系数和与生成物的系数和相等,所以n总不变,则混合气体的平均相对分子质量一直保持不变,不能说明反应达到平衡状态,⑥不符合题意;
答案选②④;
(5)该反应达到化学反应限度时,B的转化率为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学式为____________________。
(2)第③步反应的离子方程式是___________________________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_____________________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:____________________、_______________________________________。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1g,第③步反应中加入20.0mL3.0mol.![]() 的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________________gNa2CO3参加了反应。
的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________________gNa2CO3参加了反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,下列说法正确的是
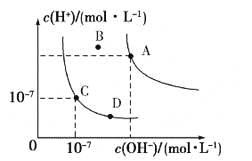
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、溶剂和医药中间体。合成α-萜品醇(G)的路线之一如下:
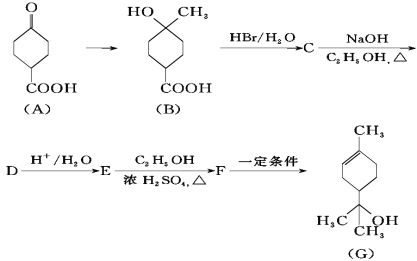
其中E的化学式为C8H12O2,请回答下列问题:
(1)A中含有的官能团名称是_____,C的结构简式为_____;
(2)由化合物C制取化合物D的反应类型为_____;
(3)试写出由化合物E制取化合物F的化学方程式:_____;
(4)化合物A满足下列条件的同分异构体有____种。
a.为链状有机物且无支链
b.能发生银镜反应
c.能和碳酸氢钠反应生成气体
(5)下列说法正确的是____(填写序号)。
a.A的核磁共振氢谱有4种峰
b.B可与FeCl3溶液发生显色反应
c.G中所有原子可能在同一平面上
d.G可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9~3.8,常温下,酒石酸(用H2T表示)水溶液中三种微粒所占的分数(a)与pH的关系如图所示。下列表述不正确的是( )
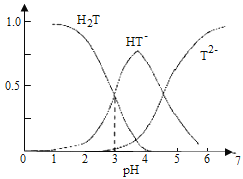
A.葡萄酒中除了存在酒石酸外,还存在酒石酸盐
B.常温下,H2T![]() H++HT-,Ka=10-3
H++HT-,Ka=10-3
C.当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2-
D.当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g)
CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g) ![]() 1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法错误的是![]()
A.开发太阳能、风能、地热能、潮汐能等新能源可以减少霾的产生
B.硅胶可用作商品包装袋内的干燥剂,也可以用作催化剂的载体
C.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
D.燃烧法可以鉴别羊毛和棉线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com