
【题目】已知水的电离平衡曲线如图所示,下列说法正确的是
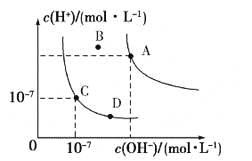
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
【答案】B
【解析】
A. 水的离子积常数只与温度有关,温度相同,则Kw相同,温度升高,则Kw增大,根据图示可知温度:A>B>C=D,所以水的离子积常数关系为:Kw(A)>Kw(B)>Kw(C)=Kw(D),错误;
B.保持温度不变,向水中加入醋酸钠固体,CH3COO-发生水解反应,消耗水电离产生的H+,使溶液中c(OH-)>c(H+),但是温度不变,所以Kw不变,可从C点到D点,正确;
C. B点对应的温度下,pH=4的硫酸c(H+)=10-4mol/L,pH=10的氢氧化钠溶液,c(OH-)>10-4mol/L,二者等体积混合,碱过量,溶液显碱性,则由于中性溶液的pH<7,所以此时溶液的pH可能=7,正确;
D. 温度升高,水的离子积常数增大,所以不可实现由C点到D点,错误。


科目:高中化学 来源: 题型:
【题目】有下列各组物质。
A.O2和O3;B. 和
和 ;C.12C和13C;D.
;C.12C和13C;D. 和
和
(1)___组两物质互为同位素(填写字母序号,下同)
(2)___组两物质互为同素异形体
(3)__组两物质属于同系物
(4)___组两物质互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的![]() ,较多的
,较多的![]() 和少量
和少量![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。![]() 可供选择的试剂为铁粉、稀
可供选择的试剂为铁粉、稀![]() 、NaOH溶液等试剂
、NaOH溶液等试剂![]()
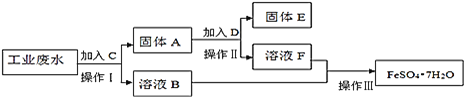
![]() 操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
![]() 固体A的成分为 ______ ,溶液B中含有的离子有 ______
固体A的成分为 ______ ,溶液B中含有的离子有 ______
![]() 加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
![]() 加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
![]() 操作Ⅲ为 ______ 。
操作Ⅲ为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
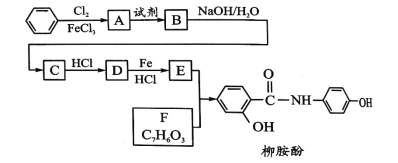
已知: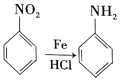
(1)对于柳胺酚,下列说法正确的是_____;
A.1mol柳胺酚最多可以和7molH2加成
B.不发生硝化反应
C.可发生消去反应
D.可与溴发生取代反应
(2)写出A→B反应所需的试剂_____;
(3)写出B→C的化学方程式______;
(4)写出化合物F的结构简式____;
(5)写出化合物E中官能团的的结构简式_____;
(6)写出同时符合下列条件的F的同分异构体的结构简式_____(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应(有醛基)
(7)以苯为原料合成苯胺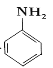 ,请设计合成路线(无机试剂及溶剂任选)_____。注:合成路线的书写格式参照如下示例流程图:CH3CHO
,请设计合成路线(无机试剂及溶剂任选)_____。注:合成路线的书写格式参照如下示例流程图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
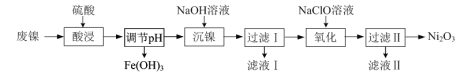
(1)“调节pH”后检验溶液中不再存在Fe3+的方法是______。
(2)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是______。
(3)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:______。
(4)若“氧化”反应不充分,所制Ni2O3样品中会混有Ni(OH)2。为测定样品中Ni2O3的质量分数,进行实验:称取5.000 g样品,加入足量硫酸后再加入100 mL 1.0 mol·L-1的Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.040 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定Ni2O3的质量分数。测定过程中涉及反应如下:Ni2O3+Fe2++H+=Ni2++Fe3++H2O(未配平);Fe2++MnO4-+H+=Fe3++Mn2++H2O(未配平)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
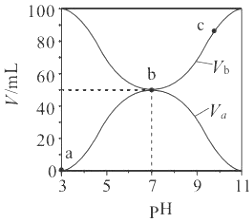
A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化曲线如图所示(其中C为有色气体),按要求解决下列问题。
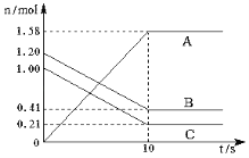
(1)该反应的化学方程式为____;
(2)用B表示的反应速率为____;
(3)下列条件改变时,能加快化学反应速率的是__请填代号)
A.扩大容器的容积 B.增大C的用量 C.降低体系的温度 D.加入催化剂
(4)该反应达到平衡状态的标志是________;
①2 v (A)=v (B) ②单位时间内生成n mol B的同时生成2n mol A ③A、B、C的浓度之比为2:1:1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变.
(5)该反应达到化学反应限度时,B的转化率为__。(请保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 用排饱和氯化钠溶液的方法来收集氯气
B. 配制和保存硫酸铁溶液常加入适量稀硫酸
C. 向氢氧化镁悬浊液中加入饱和氯化铵溶液,溶液变澄清
D. 对2 HI (g)![]() H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子数依次增加,由这些元素组成的常见物质的转化关系如图所示,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质能与沸水反应,且该单质可制造照明弹,f为固体单质。下列有关说法正确的是

A.简单离子半径:Y>Z>X
B.元素的非金属性:W>X
C.X、Y两种元素组成的化合物只含离子键
D.最高价氧化物对应水化物的碱性:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com