
【题目】某工厂的工业废水中含有大量的![]() ,较多的
,较多的![]() 和少量
和少量![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。![]() 可供选择的试剂为铁粉、稀
可供选择的试剂为铁粉、稀![]() 、NaOH溶液等试剂
、NaOH溶液等试剂![]()
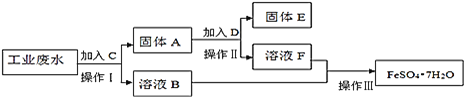
![]() 操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
![]() 固体A的成分为 ______ ,溶液B中含有的离子有 ______
固体A的成分为 ______ ,溶液B中含有的离子有 ______
![]() 加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
![]() 加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
![]() 操作Ⅲ为 ______ 。
操作Ⅲ为 ______ 。
【答案】过滤 漏斗、玻璃棒、烧杯 ![]() 、Cu
、Cu ![]() 、
、![]() 、
、![]() 将
将![]() 全部转化为Cu,以便回收铜单质
全部转化为Cu,以便回收铜单质 ![]() 稀硫酸
稀硫酸 ![]() 蒸发浓缩、冷却结晶、过滤、洗涤、干燥
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
【解析】
先向工业废水中加过量铁,将铜全部置换出来,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4;向固体A中加入过量稀H2SO4,只有铁溶解,过滤得到固体E(铜),实现了回收金属铜,溶液F含FeSO4、H2SO4;最后溶液B和F合一块,进行蒸发,浓缩,冷却结晶,过滤,就得到FeSO47H2O,回收硫酸亚铁,以此解答该题。
(1)操作Ⅰ为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得到固体A,其成分是铜和过量的铁,溶液B中含![]() 和少量
和少量![]() ,则溶液B中含有的离子有:
,则溶液B中含有的离子有:![]() 、
、![]() 、
、![]() ,故答案为:Fe、Cu;
,故答案为:Fe、Cu;![]() 、
、![]() 、
、![]() ;
;
(3)加过量铁,将![]() 全部转化为Cu,以便回收铜单质,发生的化学方程式为:
全部转化为Cu,以便回收铜单质,发生的化学方程式为:![]() ,故答案为:将
,故答案为:将![]() 全部转化为Cu,以便回收铜单质;
全部转化为Cu,以便回收铜单质;![]() ;
;
(4)固体A的成分是铜和过量的铁,向固体A中加入过量D为稀![]() ,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:
,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:![]() ,
,
故答案为:稀硫酸;![]() ;
;
(5)从溶液B和溶液F中得到![]() 晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】如图所示表示一些元素原子半径规律性的变化示意图。由此图不能得出下列结论的是(不考虑稀有气体元素)

A.当电子层数相同时,核电荷数越小,原子半径越大
B.当最外层电子数相同时,质子数越多,原子半径越大
C.r(F-)<r(Cl-)<r(Br-)<r(I-),r(K+)>r(Na+)>r(Mg2+)>r(Al3+)
D.原子电子层数越多,对应的原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示。有关说法正确的是( )

A. 1 mol阿司匹林最多可消耗3 molH2
B. 水杨酸分子中所有原子不可能共面
C. 水杨酸可以发生取代、加成、氧化、加聚反应
D. 1 mol阿司匹林最多可消耗2 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() 提取氧化铝做冶炼铝的原料,提取的操作流程如下:
提取氧化铝做冶炼铝的原料,提取的操作流程如下:
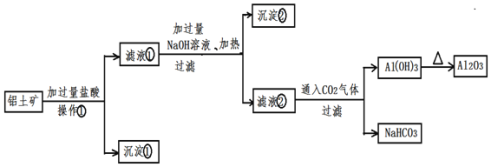
请回答下列问题:
![]() 操作
操作![]() 的名称:______
的名称:______
![]() 沉淀
沉淀![]() 的化学式:______沉淀
的化学式:______沉淀![]() 的化学式:______
的化学式:______
![]() 写出沉淀
写出沉淀![]() 与NaOH溶液反应的化学方程式:______
与NaOH溶液反应的化学方程式:______
![]() 写出滤液
写出滤液![]() 与NaOH溶液反应生成沉淀
与NaOH溶液反应生成沉淀![]() 的离子方程式:______
的离子方程式:______
![]() 尝试写出滤液
尝试写出滤液![]() 中通入
中通入![]() 后的反应方程式:______
后的反应方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子序数依次减小且三者原子序数之和为16,其常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是

A. X元素位于ⅥA族
B. 1 mol Y和3 mol Z在一定条件下充分反应生成2 mol C
C. A和C在一定条件下能发生氧化还原反应
D. C和X一定条件下能反应生成A和B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:

(1)第②步反应得到的沉淀X的化学式为____________________。
(2)第③步反应的离子方程式是___________________________。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有_____________________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:____________________、_______________________________________。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1g,第③步反应中加入20.0mL3.0mol.![]() 的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________________gNa2CO3参加了反应。
的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有________________gNa2CO3参加了反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,下列说法正确的是
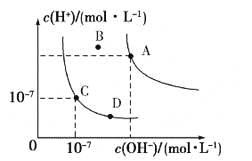
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g)
CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g) ![]() 1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com