
����Ŀ��[��ѧһѡ��3:���ʽṹ������]̼������п�ĵ��ʼ��仯�����й㷺��Ӧ�á�
(1)д����̬̼ԭ�ӵļ۵��ӵ����Ų�ͼ____��1mol�����Ƿ����к��ЦҼ�___����
(2)Ge��Cͬ���壬���ʲ���ȴ�ܴ�Cԭ�Ӽ�����γ�˫��������������Geԭ��֮�������γ�˫�����������ӽṹ�Ϸ�����ԭ����______________________________��
(3)�������백�����γ�������[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ____________________���ṩ�µ��ӶԵijɼ�ԭ����_____________________�����ķе�����(PH3)��ԭ����___________________��
(4)ZnO����������־���ṹ����п��ṹ���Ȼ��ƽṹ���Ȼ�綠ṹ����п��ṹ(�����ṹ����ԭ�Ӳ��������������)
������п�����������ṹ�ı����Ҫ������____________��
a.������� b.�������� c.��������
����п��ṹ��ͼ��Ʒ����Zn2+��O2-���������Ϊ__________cm��(�辧���߳�Ϊbmm)

���𰸡� ![]() 23NA Geԭ�Ӱ뾶�������γ��ȶ��Ħм��������γ�˫�������� ��λ�� N �����Ӽ��γ���� b
23NA Geԭ�Ӱ뾶�������γ��ȶ��Ħм��������γ�˫�������� ��λ�� N �����Ӽ��γ���� b ![]() ��b��10-1
��b��10-1
����������1��Cԭ�ӵ�ԭ������Ϊ6����̬Cԭ�ӵļ۵��ӵ����Ų�ͼΪ��![]() �������Ƿ��ӵĽṹʽΪ��
�������Ƿ��ӵĽṹʽΪ��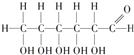 ��1mol�����Ƿ����к���23NA���Ҽ�,��Ϊ��
��1mol�����Ƿ����к���23NA���Ҽ�,��Ϊ��![]() ��23NA
��23NA
��2��Geԭ�Ӱ뾶��ԭ�Ӽ��γɵ��������ϳ���p-p����粢���ص��̶Ⱥ�С�������ص��������γ���������Ϊ��Geԭ�Ӱ뾶�������γ��ȶ��Ħм��������γ�˫��������
��3��[Ni(NH3)6]2+��Ni2+��NH3֮������λ�����ϣ��γɵĻ�ѧ����Ϊ��λ����NH3�ŶԵ���ռ��Ni2+�Ŀչ��������ṩ�µ��ӶԵijɼ�ԭ����N��NH3���Ӽ������������Ӽ�������������ۻ�������ʱ������Ҫ�˷�����ķ��Ӽ����⣬���������ع�Ӧһ���������ƻ����Ӽ����������°��ķе�����(PH3)����Ϊ����λ�� �� N �������Ӽ��γ����
��4����ZnO�����еĻ�ѧ���������Ӽ��ijɷ֣����й��ۼ��ijɷ֣����ֳɷֵĺ�����࣬���ʹ��ZnO�����еĻ�ѧ��û�����Ӿ�����ôǿ����������һ������������¸�����������ṹ�ϵĸı䡣������Zn2+��O2-��������룬���ݽṹͼ������Ҫ��һ����������Ķ��㵽���ĵľ��룬Ҳ������ͼ����AG�ľ��룬ABCD��п��G������
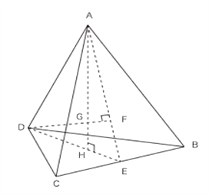
����CD�ij������p����ôAH=![]() p�� AG��GH=3��1�����İ���������ĸ߷ֳ�3��1�����ݡ��Ӿ������������������ѻ����ϵĶԽ����ǹؼ������ԣ�CD��2=�Խ��߳�=
p�� AG��GH=3��1�����İ���������ĸ߷ֳ�3��1�����ݡ��Ӿ������������������ѻ����ϵĶԽ����ǹؼ������ԣ�CD��2=�Խ��߳�=![]() �������߳�����ˣ�CD=p=
�������߳�����ˣ�CD=p=![]() b��b�Ǿ����߳���Zn2+��O2-�ľ�����AG=
b��b�Ǿ����߳���Zn2+��O2-�ľ�����AG=![]() AH=
AH=![]() ��
��![]() p =p=
p =p=![]() ��
��![]() b=
b= ![]() bmm=
bmm=![]() b
b![]() cm���� b��
cm���� b��![]() b
b![]()



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M�м��ۻ������أ���ṹ��ͼ��ʾ���������㶹������Ȼ�������M��������������ȷ���ǣ�������
A.���������������ȵ������£�1molM������5molH2�����ӳɷ�Ӧ
B.M��ʹ����KMnO4��Һ��ɫ
C.M�����ȵ�NaOH��Һ�з�����Ӧ����������3molNaOH
D.1molM����3molBr2����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.ʵ���ҴӺ�����ȡ���ʵ�ķ����ǣ�ȡ�������ա��ܽ�����ˡ���ȡ
B.���Ҵ���ŨH2SO4�Ʊ���ϩʱ������ˮԡ���ȿ��Ʒ�Ӧ���¶�
C.�����Ӵ���ʱ�����������Ĥ�ױ��ƻ�����˺�������Ʒ����ֱ�ӷ�������������
D.����NH4��2SO4��CuSO4��Һ�ֱ���뵰������Һ�����ֳ������������߾���ʹ�����ʱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ʾһ��ԭ���ڵ������Ӳ�����10�����ӣ�����д���� ��
A. 3s23p64s2 B. 3f10 C. 3s23p63d2 D. 3d10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CaO2)��һ�ֶԻ����ѺõĶ���������
I.���÷�ӦCa2++H2O2+2NH3+8H2O= CaO2��8H2O��+2NH4+����ȡCaO2��װ������:

��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��NH3��Ca2+��H2O2�ķ�Ӧ�����������������__________________________________��
��װ��B��������_____________����Ӧ�ڱ�ˮԡ�н��е�ԭ����_____________________��
�ܷ�Ӧ���������ˡ�ϴ�ӡ����º�ɿɻ��CaO2��8H2O������CaO2��8H2O�Ƿ�ϴ�Ӹɾ��IJ���Ϊ_______________________________________________________��
II.������CaO2��8H2O��ˮ���CaO2��Ʒ��������ַ����ⶨ��Ʒ��CaO2�ĺ�����
��������
��֪CaO2��350��Ѹ�ٷֽ�����CaO��O2������ȡ��Ʒ������xg������������ʱ��ʣ�����yg�����Ʒ��CaO2����������Ϊ____________(����ĸ��ʾ)��
�ڵζ���
����һ��ȷ��ȡag��Ʒ��������ƿ�У�������������ˮ������bg KI���壬�ٵ�������2mol/L��������Һ����ַ�Ӧ��
���������������ƿ�м��뼸�ε�����Һ��
����������μ���Ũ��Ϊc mol/L��Na2S2O3��Һ����Ӧ��ȫ���ζ����յ㣬��¼���ݣ��ظ������������ó�����ƽ������Na2S2O3��Һ���ΪVmL��
CaO2����������Ϊ_________(����ĸ��ʾ)[��֪:I2+2S2O32-=2I-+S4O62-]�����ζ���������ƿ���ڼ��ҵ���������Һ���������õ���������_____________(�ƫ����ƫС������Ӱ�족)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�¶�Tʱˮ�����ӻ�����ΪKW �� ���¶��£���Ũ��Ϊa mol/L��һԪ��HA��b mol/LһԪ��BOH�������ϣ����ж�����Һ�����Ե������ǣ�������
A.�����Һ��pH=7
B.�����Һ�У�c��H+��= ![]() mol/L
mol/L
C.a=b
D.�����Һ�У�c��H+��+c��B+��=c��OH����+c��A����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ԭ�ӻ����ӵĵ�������ʽ�������� �� ��
A. Na+1s22s22p6 B. N3+ 1s22s22p6
C. F1s22s22p6 D. O21s22s22p6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 ��ʱ��ij��̬����������ϣ�װ���ܱ������У���ȼ��ը���ָֻ���20 �棬��ʱ�����������ѹǿΪ��Ӧǰ��һ�룬��NaOH��Һ���պ������ڼ�������գ������ķ���ʽ������(����)
A. CH4 B. C2H6 C. C3H8 D. C7H16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�л���F(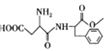 )��һ��Ӧ�ù㷺��ʳ�õ���ζ�����׳Ƶ����ǣ�����һ�ֺϳ�·����ͼ��ʾ��
)��һ��Ӧ�ù㷺��ʳ�õ���ζ�����׳Ƶ����ǣ�����һ�ֺϳ�·����ͼ��ʾ��
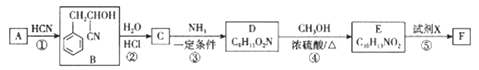
��֪����.A�ܷ���������Ӧ
��. ![]()
��ش��������⣺
(1)D�й����ŵ�����Ϊ_______________��F�ķ���ʽΪ___________________��
(2)A������Ϊ__________����Ӧ�� �ķ�Ӧ����Ϊ________________��
(3)��Ӧ�ܵĻ�ѧ����ʽΪ_______________________��
(4)��Ӧ���е���һ����������ˮ����X�Ľṹ��ʽΪ__________________��
(5)D�ж��ַ�����ͬ���칹�壬���з���������������_________��(�����������칹)��
����D������ͬ�Ĺ����� �ڱ�������2 ��ȡ����
���к˴Ź�������Ϊ6����ҷ������Ϊ2��2��2��2��2��1�Ľṹ��ʽΪ____________(д��һ�ּ���)��
(6)��ϩ������Ҫ���л��ϳ�ԭ�ϼ��ϳ���֬���壬��д����CH3CHOΪԭ�Ϻϳɱ�ϩ��ĺϳ�·��________________________ (�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com